

柔性压电纳米发电机的发展在过去十年中经历了快速发展,并正在成为未来最先进的个性化医疗保健的技术基础。由于其高效的机械到电能转换、易于实施和自供电特性,这些设备在主动传感、电刺激治疗以及人体生物力学能量收集领域进行大量创新的医疗保健应用。本文全面回顾了用于个性化医疗保健的压电纳米发电机(PENG)。在简要介绍了压电效应的基础原理之后,还系统地讨论了材料工程策略、器件结构设计以及以人体为中心的能量收集、传感和治疗应用。此外,还详细概述了利用压电纳米发电机进行自供电生物电子学和个性化医疗保健的挑战和机遇。
随着传感和信息网络技术的显着进步,互联网不再局限于在计算机、手机等传统智能设备上实现互联互通。如今,新的技术平台也可以将这些交互能力扩展到日常物体和个人,并逐渐形成涵盖人类生活越来越多不同方面的物联网 (IoT) 范式。新兴的纳米技术和材料科学本身也推动了柔性生物电子学的发展。结合物联网平台,智能可穿戴设备已广泛应用于健康监测、人机融合、人工智能和许多其他应用。该领域已成为科学界和工业界的青睐。更具体地说,随着 5G 技术的快速发展,可穿戴生物电子可以相互连接形成传感器网络,从而为个性化医疗提供大数据洞察,具有深远的社会经济影响。近年来,随着医疗保健,诊断模型逐渐从以医院为中心转向以患者为中心,极大地促进了可穿戴生物电子技术在个性化医疗保健方面的发展。定制的柔性可穿戴传感器可用于监测身体活动,生命体征,甚至像冠状病毒这样的传染病,为个人提供了无创且有吸引力的动态健康评估和个性化医疗。
可穿戴生物电子学能够将当前以疾病治疗为中心的医疗保健系统转变为以疾病预防和健康监测为重点的个性化模式。其中,可穿戴传感器可以从人体捕获有价值的信息实现人体健康监测,是成熟的医疗物联网 (IoMT) 系统的核心组件之一。然而,为这些可穿戴设备提供持续稳定的电源仍然是一个重大挑战。传统上,标准供电方式依赖于电池,电子设备配备独立电源以实现独立运行。有效应对此类挑战的一种方法是开发自供电传感器。可以利用生活中的生物力学能量,如:身体活动、心脏/肺运动、血液循环等形式,将这些能量转化为电能,预期将可穿戴设备与传统电池的有限寿命和频繁更换相分离,最终允许用于自供电操作。特别是对于植入式设备,自供电设备可以有效防止需要更换电源的二次手术,提供了巨大的优势和重要的应用前景。
有几种技术可以将这些生物力学能转化为电能,包括但不限于压电效应(PENGs),摩擦电效应(TENG),磁弹性效应(MEG),和电磁效应。其中,基于压电效应的压电纳米发电机(PENGs)自 2006年发明以来,因其固有的特性而备受关注。作为压电材料,PENGs具有简单的工程结构,可以实现机械能和电能的可逆转换,实现高效的机电耦合、快速响应。PENG 不仅可以作为能量收集器,还可以提供主动传感能力,包括触觉传感、应力或应变传感、声学传感等形式。当附着在人体上时,PENGs 可以监测人体活动的微弱生理信号,包括脉搏检测、呼吸监测、组织弹性模量计算、血流监测等。除了这些应用之外,产生的电力还广泛用于原位电刺激、细胞活性调节、组织再生和药物输送。近年来,随着新材料的出现随着新加工技术的发展,PENG技术发展迅速,在能源、传感和治疗领域取得了重大进展。
本综述旨在突出和涵盖在能源、传感和治疗三个领域的近期 PENG 进展,重点关注其在个性化医疗保健中的生物医学应用(图 1)。为了更好地促进对 PENG 及其在医疗保健中的应用的理解,他们开始回顾并简要介绍了PENG的基础物理工作原理。随后,介绍了一些典型的压电材料,包括无机材料、有机材料、压电复合材料和天然压电材料。进一步涵盖了各种基于压电材料的生物电子学的研究进展以及现实生活中的生物医学应用,包括在体能量收集、传感和电刺激治疗。在最后一节中,详细概述了将 PENGs 用于个性化医疗保健的挑战和机遇。

图 1:用于个性化医疗保健的 PENG,包括人体相关的能量收集、自供电传感和电刺激治疗。
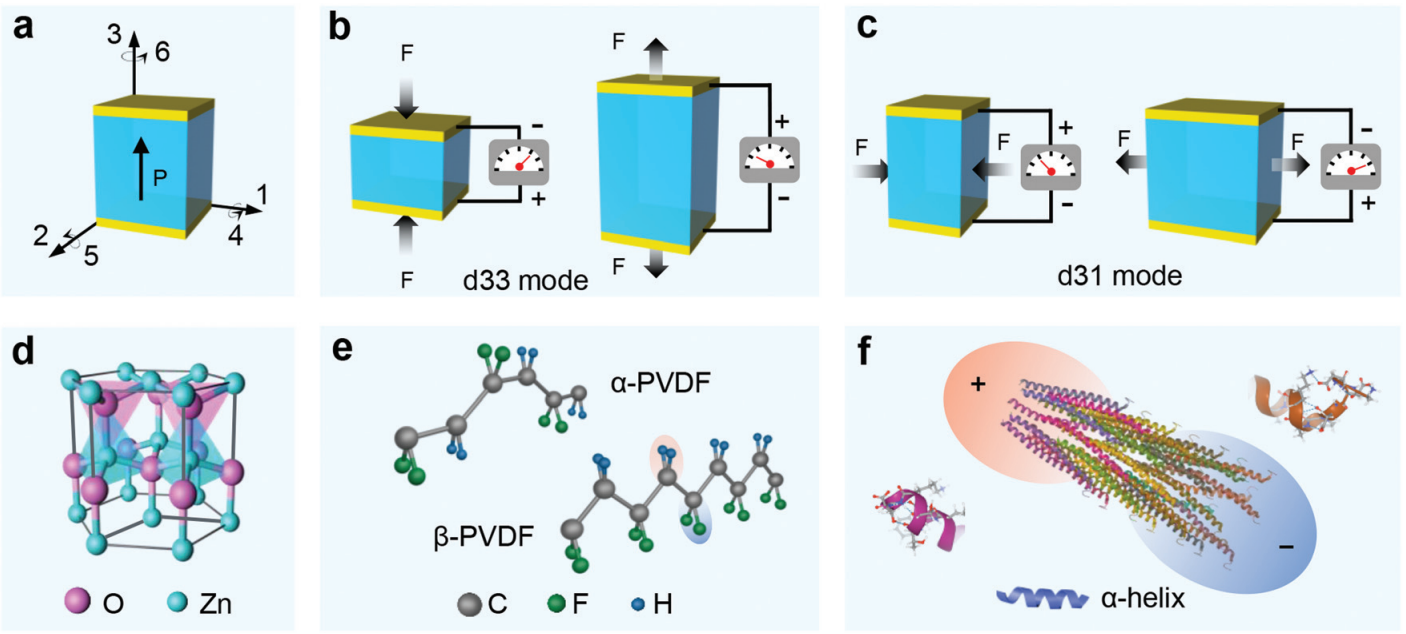
图 2:压电材料和压电性。 (a) 影响压电元件的力的方向。d33 (b) 和 d31 (c) 工作模式示意图。(d)无机压电材料ZnO的纤锌矿结构模型。(e) 有机压电聚合物 PVDF 的 α 相和 β 相结构。(f) M13 噬菌体的天然压电材料。
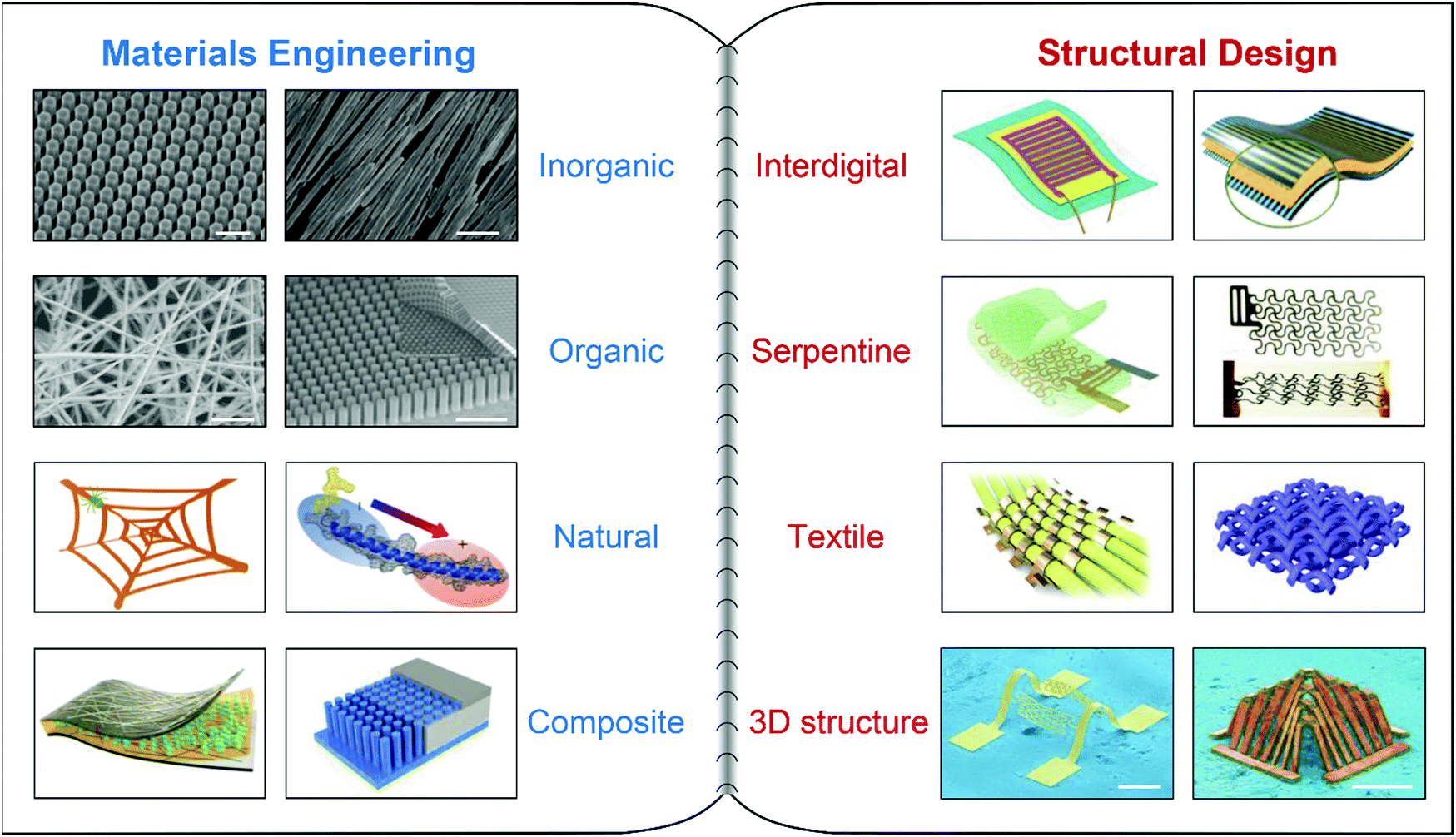
图3 PENGs的材料工程和结构设计。无机:图案化 ZnO 纳米棒的 SEM 图像(左)。比例尺,2 μm。组装后的硒纳米线的 SEM 图像(右)。比例尺,10 μm。有机物:PVDF 纳米纤维的 SEM 图像(左)。比例尺,5 μm。P(VDF-TrFE) 微柱的 SEM 图像(右)。比例尺,30 μm。自然:蜘蛛丝结构示意图(左)。单外壳蛋白示意图(右)。复合材料:展示 PVDF-铌酸盐基 PENG 结构的示意图(左)。示意图表示基于 P(VDF-TrFE)/BNNTs 纳米复合微柱的 PENG 的结构(右)。晶体管PENG 示意图(左)。带有交叉电极的 PENG 示意图(右)。弯曲:可拉伸 PVDF 电子纹身的示意图(左)和照片(右)。纺织品:基于 PVDF 的纺织品示意图(左)。织物 PENG 的示意图(右)。3D 结构:超低刚度 PVDF 细观结构(左)和带电极的 3D PVDF 细观结构(右)的 SEM 图像。比例尺,500 μm。
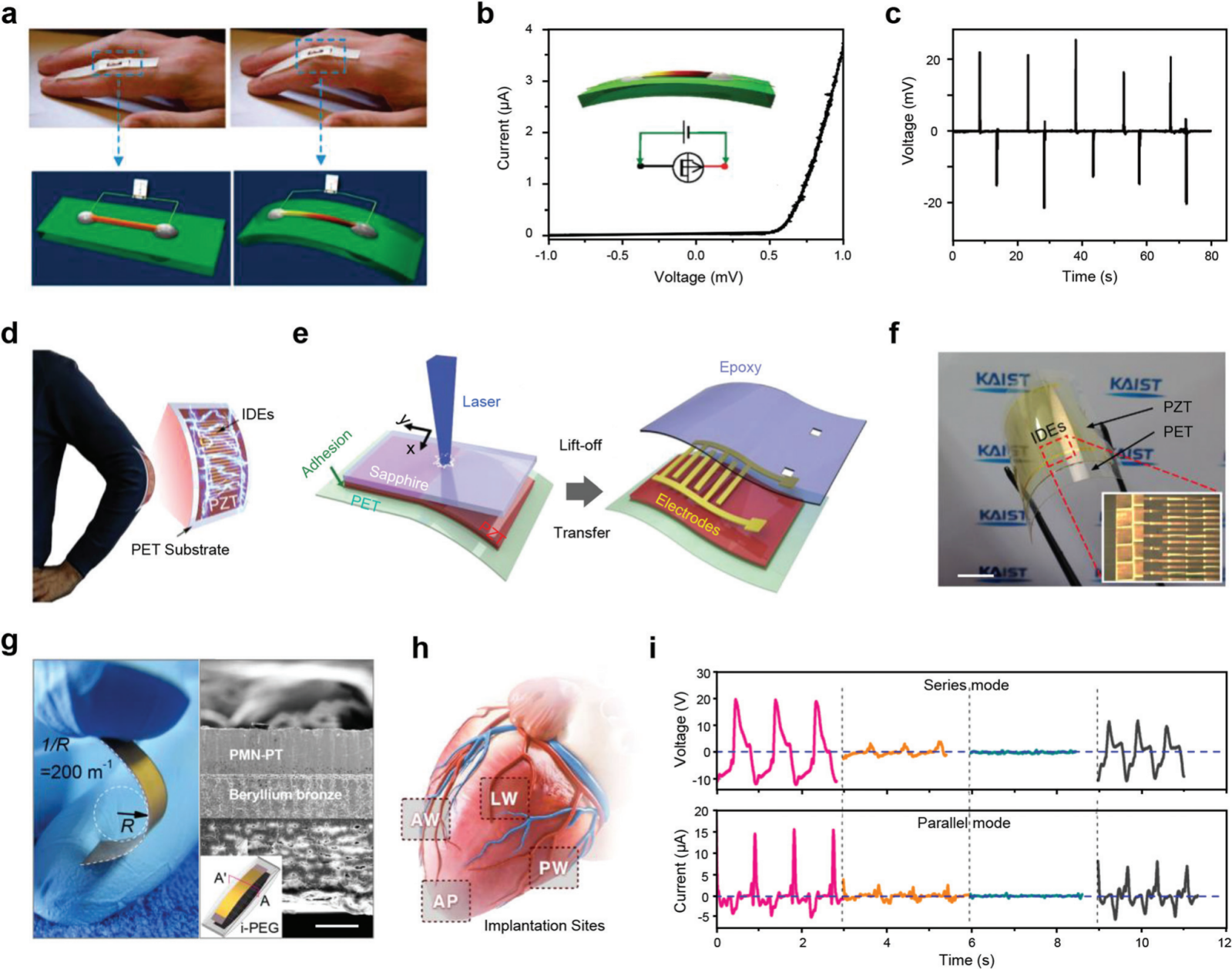
图 4 基于无机压电材料的能量收集。 (a) 基于 ZnO 纳米线的 PENG 连接到人类食指并用手指弯曲的示意图。(b) PENG 的 I-V 特性。插图说明了 PENG 的示意图及其关于测量系统的连接配置。(c) 当手指周期性地来回弯曲时,PENG 产生的开路电压。(d) 使用柔性 PZT 能量收集器的可穿戴应用的示意图。(e) 使用 LLO 方法制备柔性 PZT 薄膜基 PENG 的工艺示意图。(f) 用镊子弯曲的柔性 PZT 能量收集器的照片。比例尺,1 厘米。(g) 用手指弯曲的压电复合材料的照片和弹性骨架上压电复合材料的横截面 SEM 图像。比例尺,50 μm。(h) 不同植入部位的示意图。(i) 来自不同注入位点的串联(上)和并联(下)模式注入的 PENG 的输出性能。
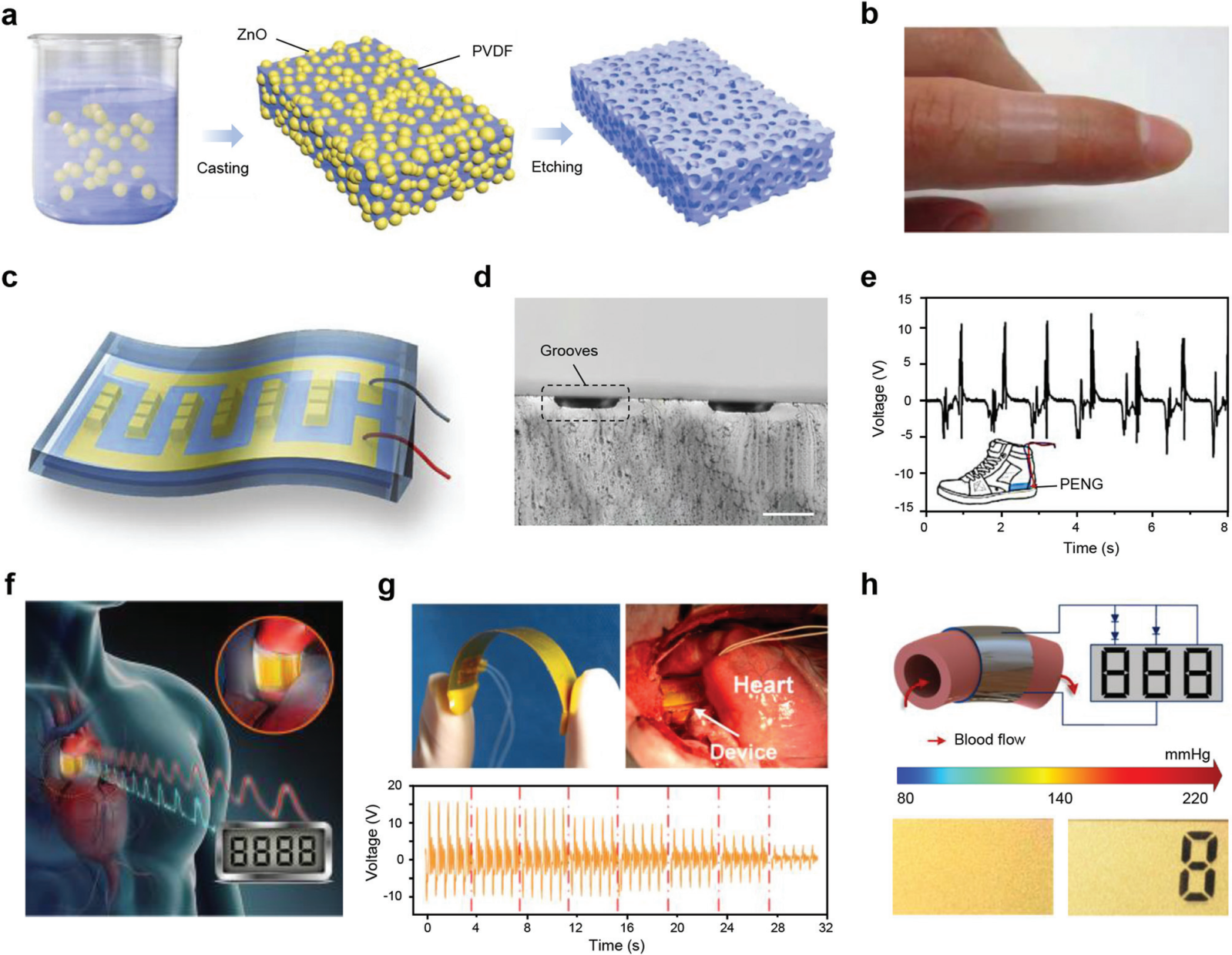
图 5 基于有机压电材料的能量收集。 (a) 制备介孔压电 PVDF 薄膜的示意图。(b) 粘附在手指表面的介孔 PVDF 薄膜的照片。(c) 基于排列的纳米纤维和 3D 叉指电极的 PENG 示意图。(d) PDMS 中凹槽横截面的显微照片。比例尺,500 μm。(e) 缓慢行走的人产生的输出电压。(f) 包裹在主动脉上时在体内使用的 PENG 示意图。(g) 该装置的照片显示其柔韧性并包裹在猪的升主动脉上(上部)。器件的输出电压随不同的压力应用而变化(下半部分)。 (h) 收缩压高于 140 mmHg 时 PENG 点亮 LCD 的系统图和照片。
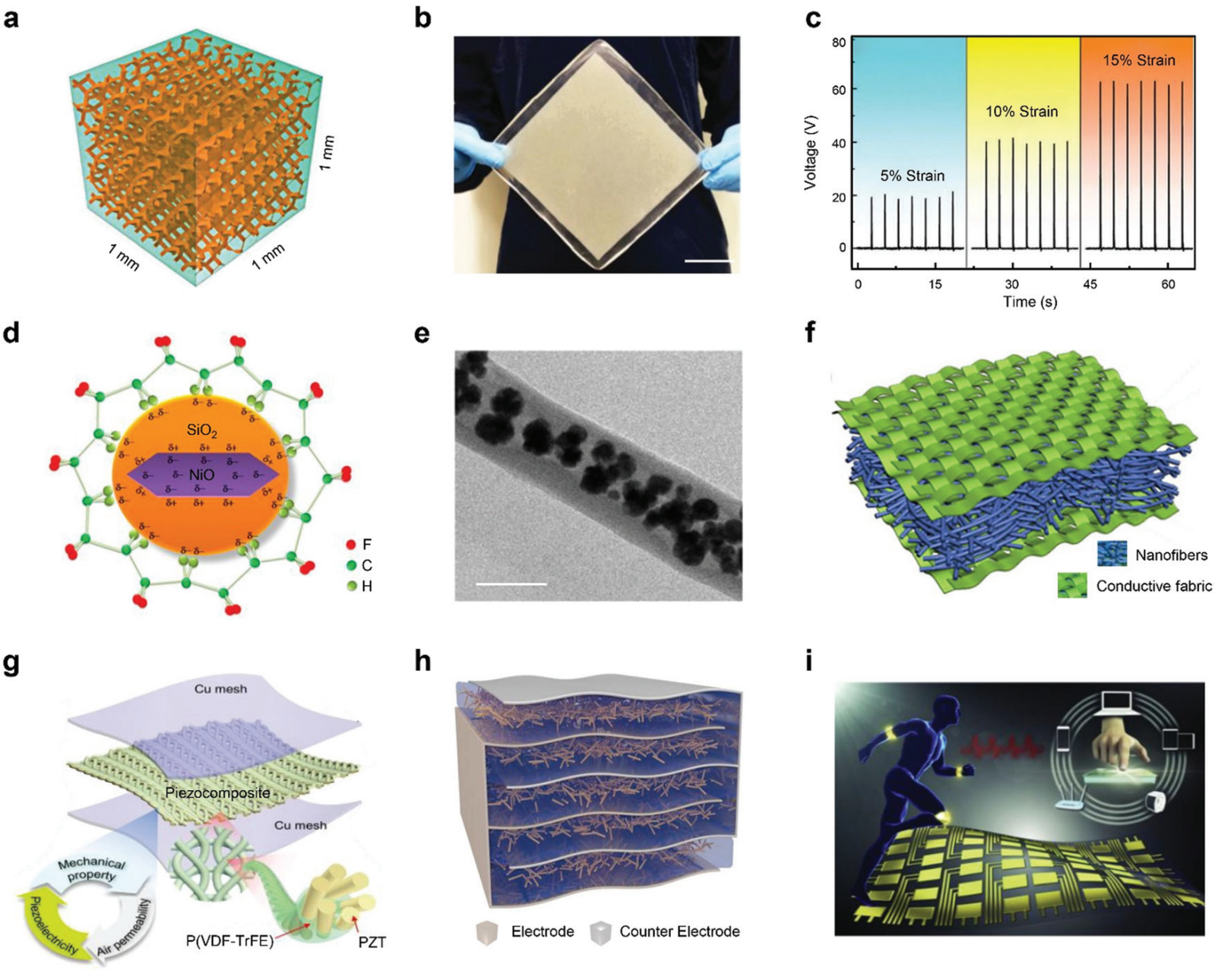
图 6 基于压电复合材料的能量收集。 (a) 3D 互连压电陶瓷泡沫基 PENG 的示意图。(b) 大面积 3D 压电复合材料的照片。比例尺,5 厘米。(c) 3D压电复合材料在不同拉伸应变下的输出电压。(d) 所提出的 β 相形成机制的示意图。(e) 核壳压电纳米纤维的 TEM 图像。比例尺,500 nm。(f) 单个电子皮肤单元的示意图。(g) 基于分层 PZT 陶瓷框架和 P(VDF-TrFE) 涂层膜的 HIPT 复合材料的示意图,以铜网作为电极。(h) 具有 3D 插层电极的基于 Sm-PMN-PT 的 PENG 的示意图。(i) 用于关节运动能量收集的制造电子皮肤的概念验证说明。
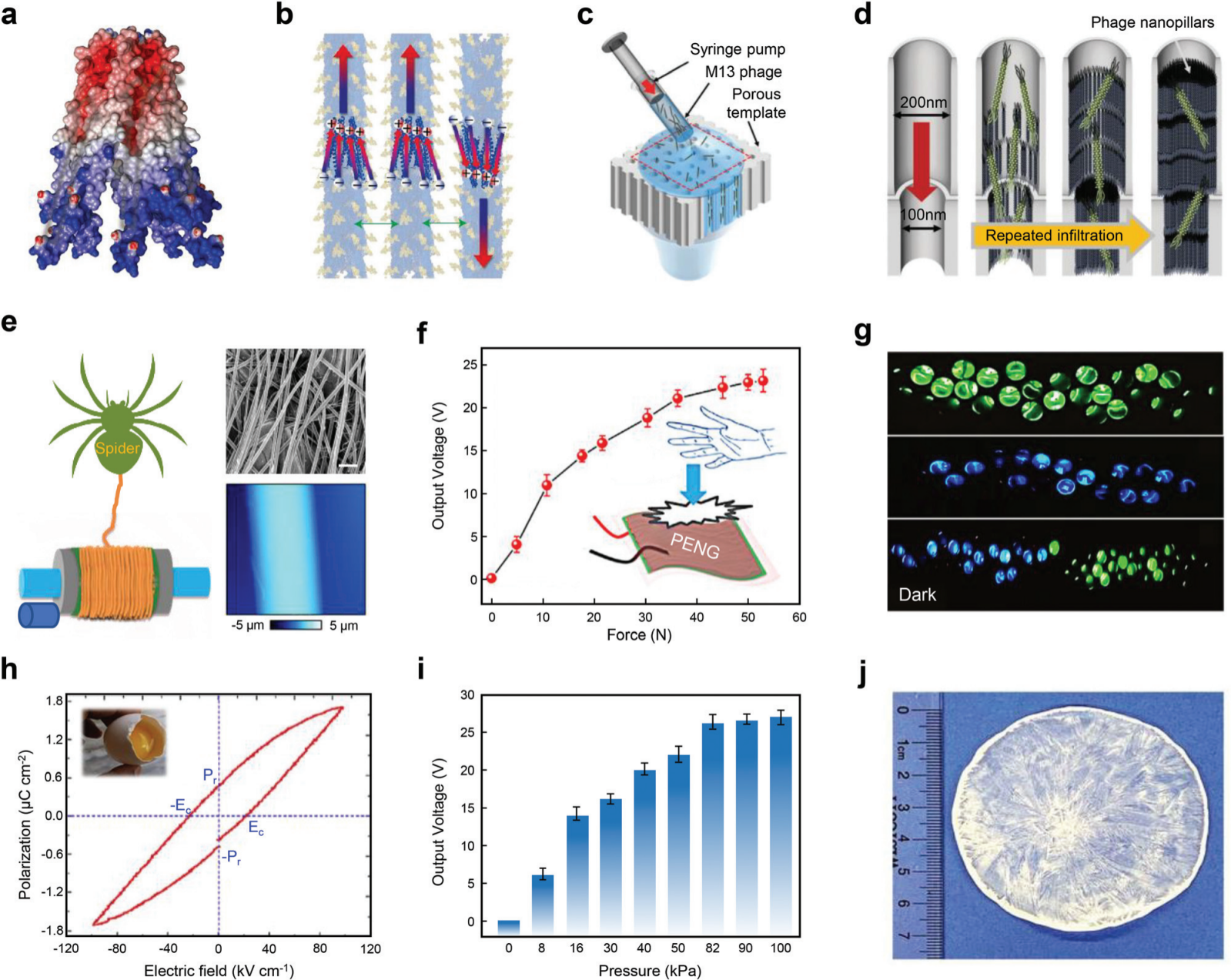
图 7 基于自然压电材料的能量收集。 (a) 用四种谷氨酸进行生物工程修饰后的压电 M13 噬菌体结构示意图。( b )通过单层的轴向方向描绘具有随机混合偶极子的噬菌体的压电特性的示意图。(c) 垂直排列的 M13 噬菌体组装的强制渗透示意图。(d) 由多孔模板中的重复渗透控制的噬菌体纳米柱形成的示意图。(e)蜘蛛丝结构示意图(左)。天然蜘蛛丝的 SEM 图像(右上)。比例尺,20 μm。蜘蛛丝的地形图(右下)。(f) PENG 在外力作用下产生的输出电压。(g) 3 个串联单元产生的电力立即点亮绿色和蓝色 LED。(h) 非极化 ESM 的极化和电场曲线。(i) 与压力相关的输出电压。(j) 晶片大小的压电甘氨酸-PVA 薄膜的数码照片。
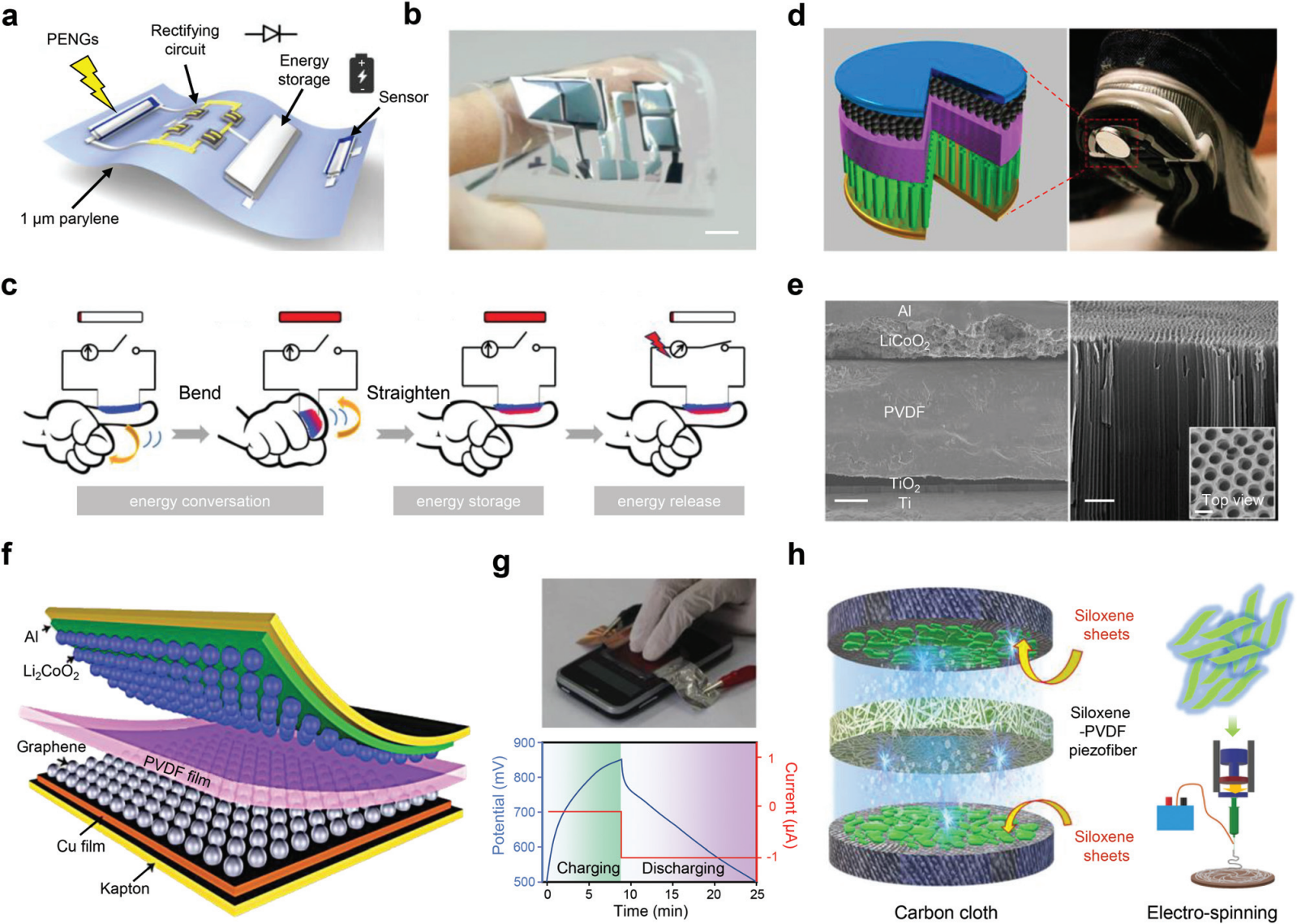
图 8 能量收集和存储的集成。 (a) 集成在 1 μm 薄聚对二甲苯基板上的一系列超柔性器件的方案。(b) 用于收集生物力学能量的超柔性 PENG 的照片。比例尺,1 厘米。(c) 纳米复合膜在生物运动下的能量转换和储存示意图。(d) PENG和锂离子电池混合的自充电电池结构设计。(e) 自充电电池的横截面 SEM 图像(左下角)。比例尺,30 μm。对齐的 TiO2 纳米管的放大图(右下角)。比例尺,1 μm。插图是纳米管的顶视图 SEM 图像。比例尺,200 nm。(f) 显示柔性自充电电池设计的示意图。(g) 通过手指按压充电的柔性自充电电池的照片(上部)。一个典型的自充电和相应的放电过程(下图)。(h) 基于硅氧烷的自充电电池的示意图。
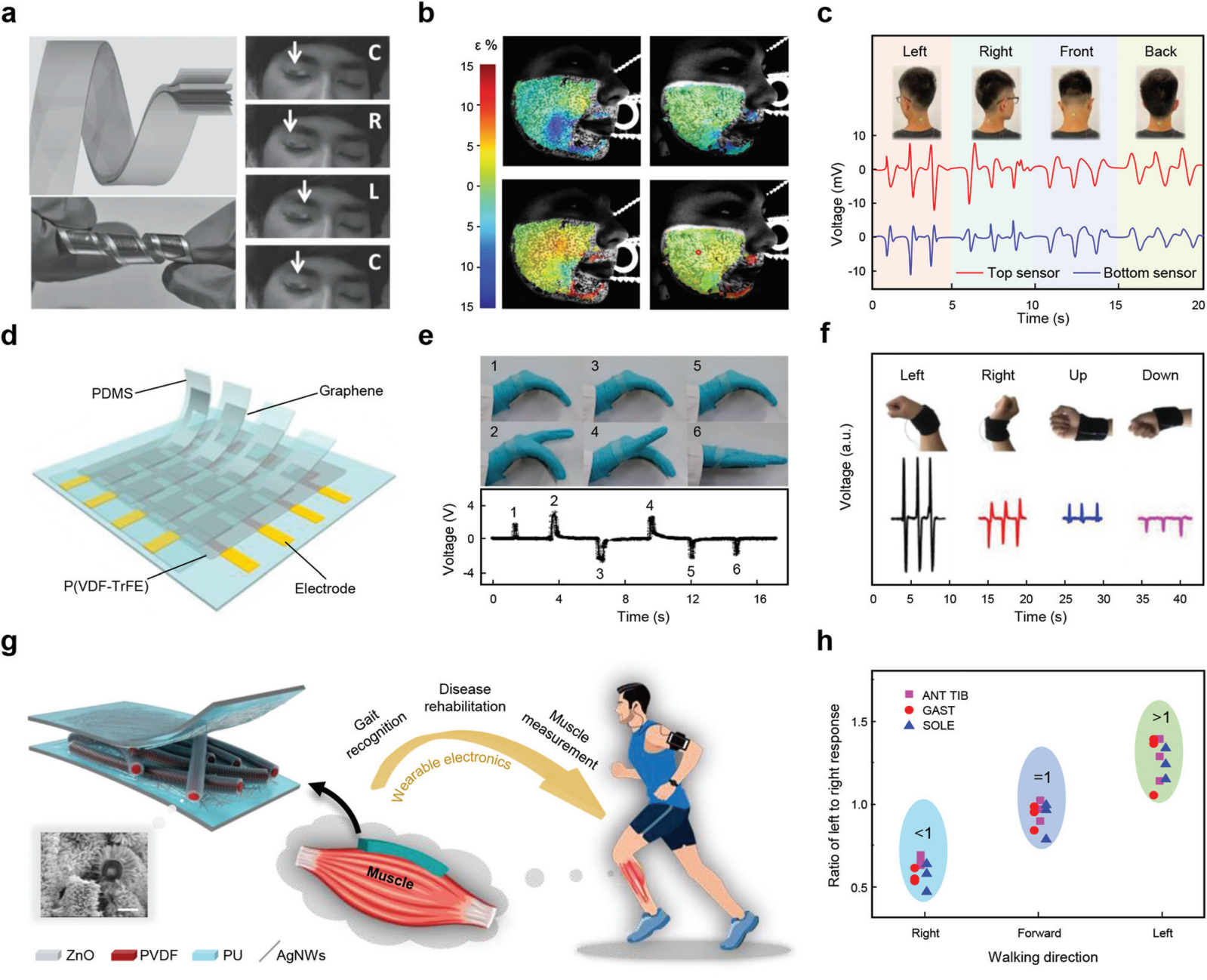
图 9 用于人体运动感应的 PENG。(a) 超薄纳米发电机作为追踪眼球运动的自供电皮肤传感器。(b) 在参与者进行面部动作(例如右脸颊抽搐)时分析皮肤应变。左侧的图像显示应变图作为人类参与者使用传感器(左)和不使用传感器(右)的结果示例,显示最小主应变(顶部)和最大主应变(底部)。(c) 基于压电陶瓷剪纸的颈部运动产生的电信号的实验结果。(d) 多级感觉矩阵的示意图。(e) 附在手掌上的四列多传感器的照片图像,用于捕捉手弯曲和手指抬起的运动(上图)和相应的传感信号(下图)。(f) 智能腕带在各种手腕运动下的输出信号。(g) 用于肌肉行为监测的三维分级联锁 PVDF/ZnO 纤维基 PENG 示意图。比例尺,1 μm。(h) 不同步行方向的小腿反应幅度(右腿)与另一条小腿反应幅度(左腿)的比值。
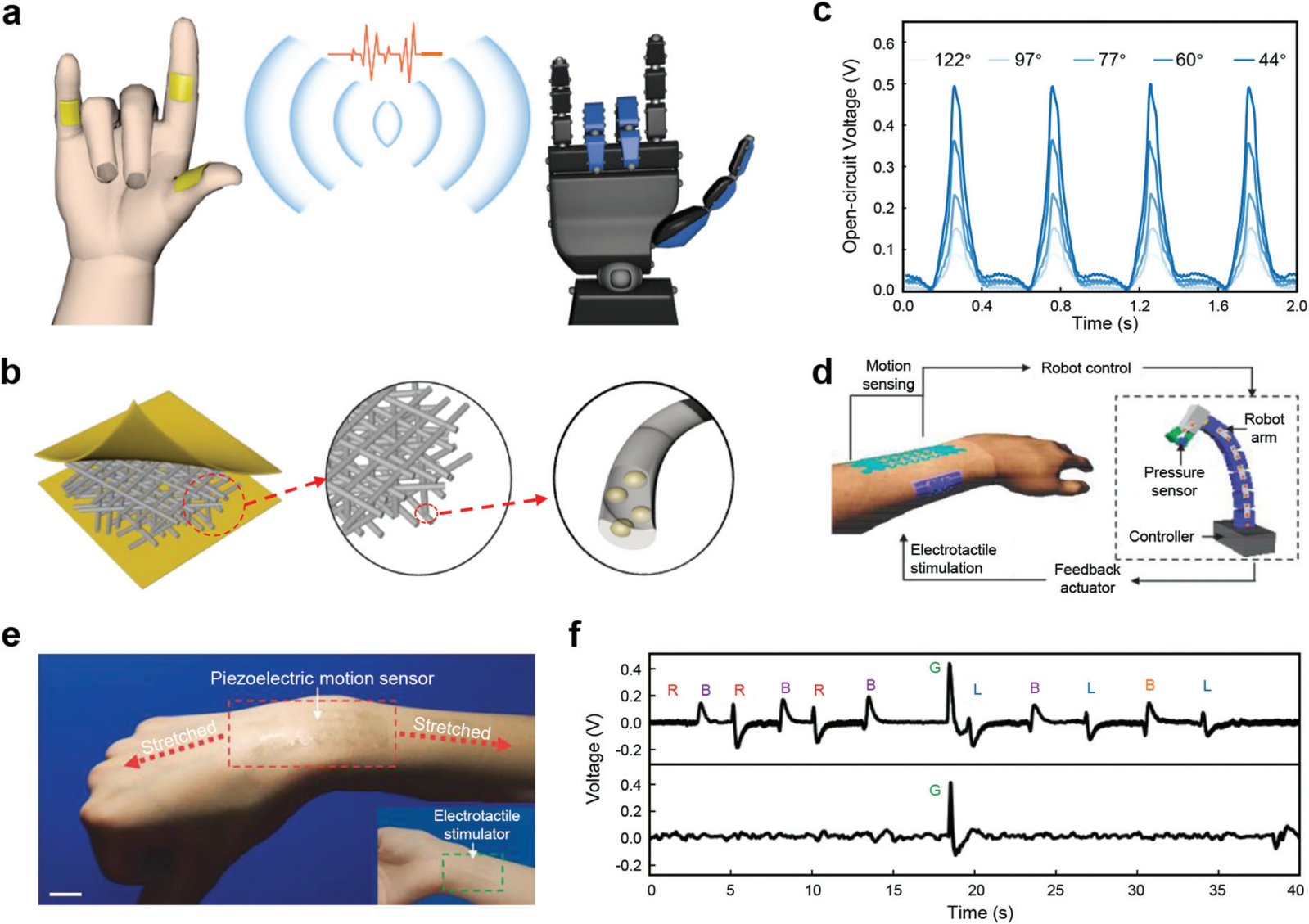
图 10 用于人机交互的 PENG。 (a) 基于豇豆结构的 PVDF/ZnO 纳米纤维的自供电压电传感器示意图,用于远程控制手势。(b) 包含纳米纤维薄膜和单根纳米纤维的设计装置示意图。(c) 以不同角度弯曲产生的开路电压。(d) 交互式人机界面闭环系统示意图。(e) 透明压电运动传感器和电触觉刺激器的图像(插图)。比例尺,20 毫米。(f) 由透明运动传感器(第一行)和夹具上的压力传感器(第二行)获取的检测信号。
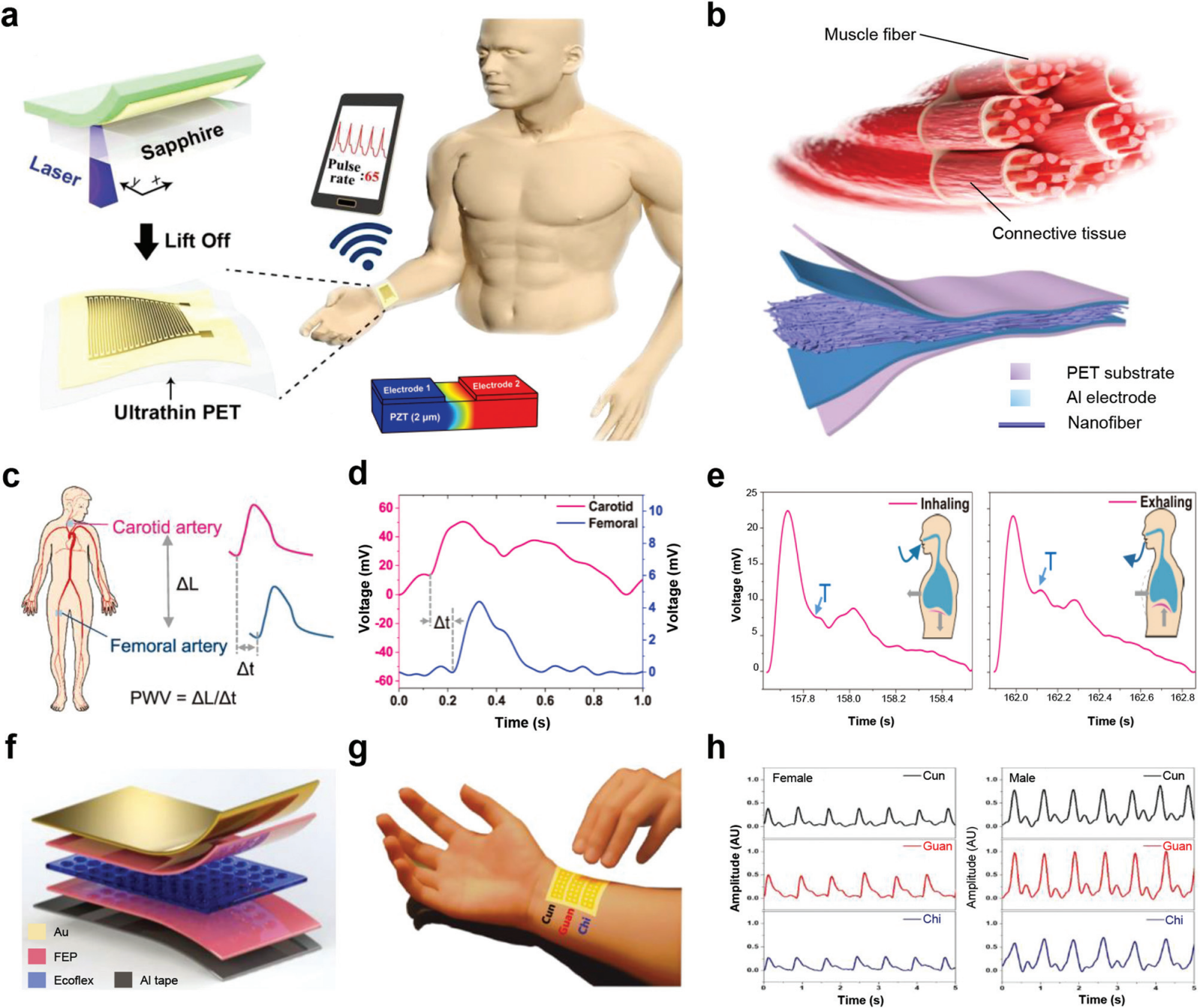
图 11 用于生命体征传感的 PENG。 (a) 基于 PZT 薄膜的自供电压力传感器的制造过程示意图。( b )由结缔组织增强的肌肉纤维和制成的肌肉纤维启发压电纺织品的示意图。(c) PWV 计算示意图。(d) 用于 PWV 计算的颈股动脉脉搏波形。(e) 深呼吸过程中吸气和呼气期间的肱动脉脉搏波形。(f) 使用 FEP/Ecoflex/FEP 夹层结构压电驻极体薄膜的脉冲传感装置示意图。(g) 模拟真实医生的传统中医脉搏采集方案,使用三指与脉搏感应系统在寸、关、尺位置。(h) 分别为女性和男性志愿者在寸、关和池位置测量的典型脉搏波形。
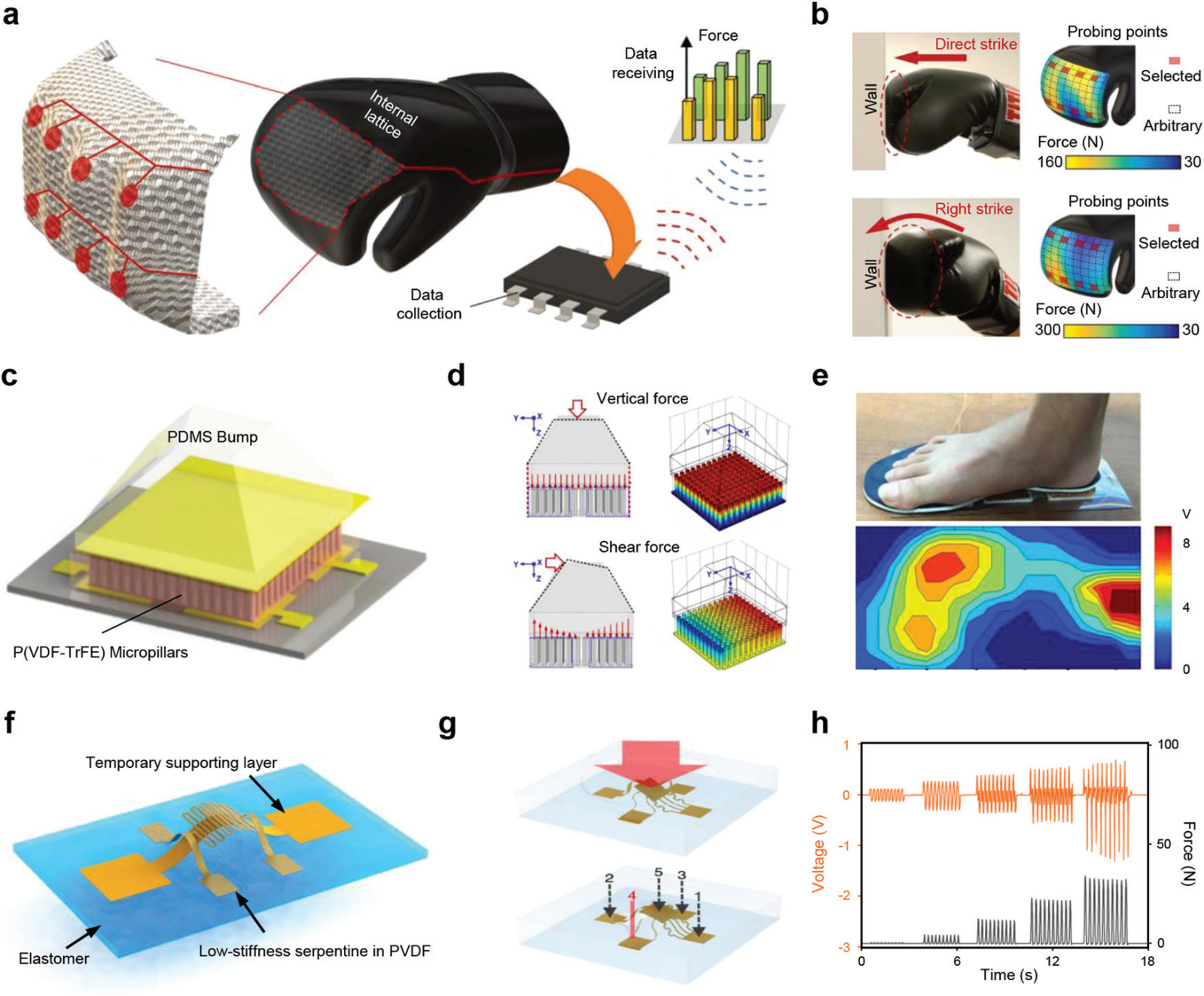
图 12 用于体外生物力学传感的 PENG。(a) 基于具有拉伸主导微架构的 3D 打印柔性压电晶格的无线自感应拳击手套示意图。(b) 手套的光学图像和力量大小的空间分布,当它分别通过直接打击和右勾拳击中墙壁时。(c) 基于压印 P(VDF-TrFE) 微柱阵列的柔性压电三轴触觉传感器示意图。(d) 三轴触觉传感器在法向力和剪切力下的模拟。(e) 集成自供电足部压力传感器阵列的照片和来自物体的压力势的二维等高线图映射。(f) 具有超低刚度的 3D 中尺度压电框架。(g)在大面积(顶部)和小面积(底部)施加压力的装置示意图。(h) 在平方区域上施加不同外力(深灰色曲线)的时域输出电压(橙色曲线)。
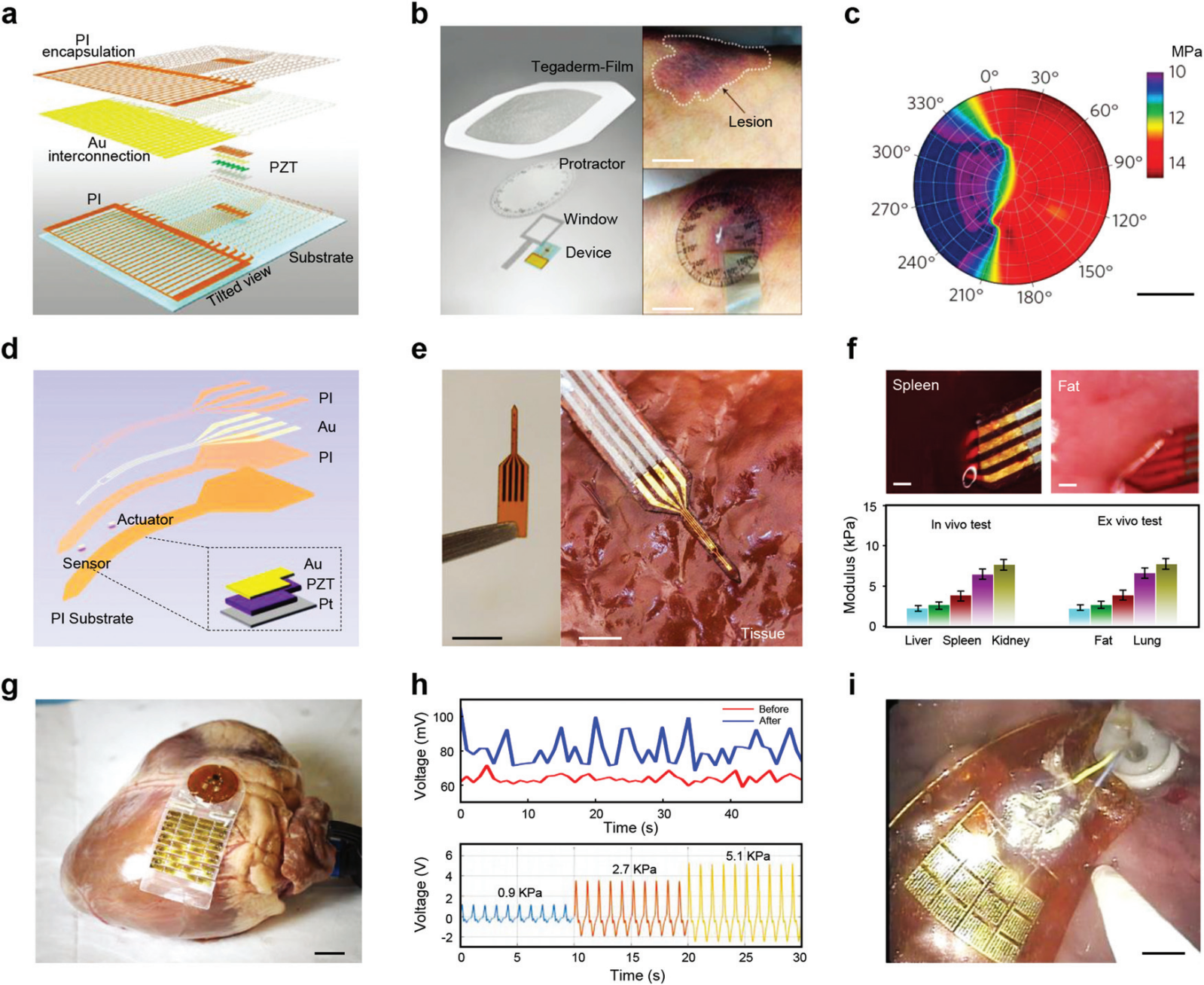
图 13 用于体内生物力学传感的 PENG。 (a) 基于 PZT 纳米带的模量传感器的分解示意图。(b) 系统示意图和前臂照片(不带和带安装设备)。(c) 来自实验的代表性数据。比例尺,2 厘米。(d) 基于超薄 PZT 执行器和传感器的设备示意图。(e) 所述装置(左,比例尺,5 mm)和放置在生物组织上的装置(右,比例尺,2 mm)的光学图像。(f) 活体大鼠体内模量测量的光学图像和结果以及解释后相同器官的离体结果。比例尺,1 毫米。 (g) 可植入传感器在组织(猪心脏)表面的潜在应用。比例尺,1 厘米。(h) 不同压力下猪心脏上传感器的电压输出,以及气动平台上的脉冲和类似心跳的输入(底部)。约克夏猪模型(上)的体内评估中摄入牛奶前后的电压输出图。(i) 基于 PZT 的传感器与胃内经皮内窥镜胃造口管的照片。比例尺,1 厘米。
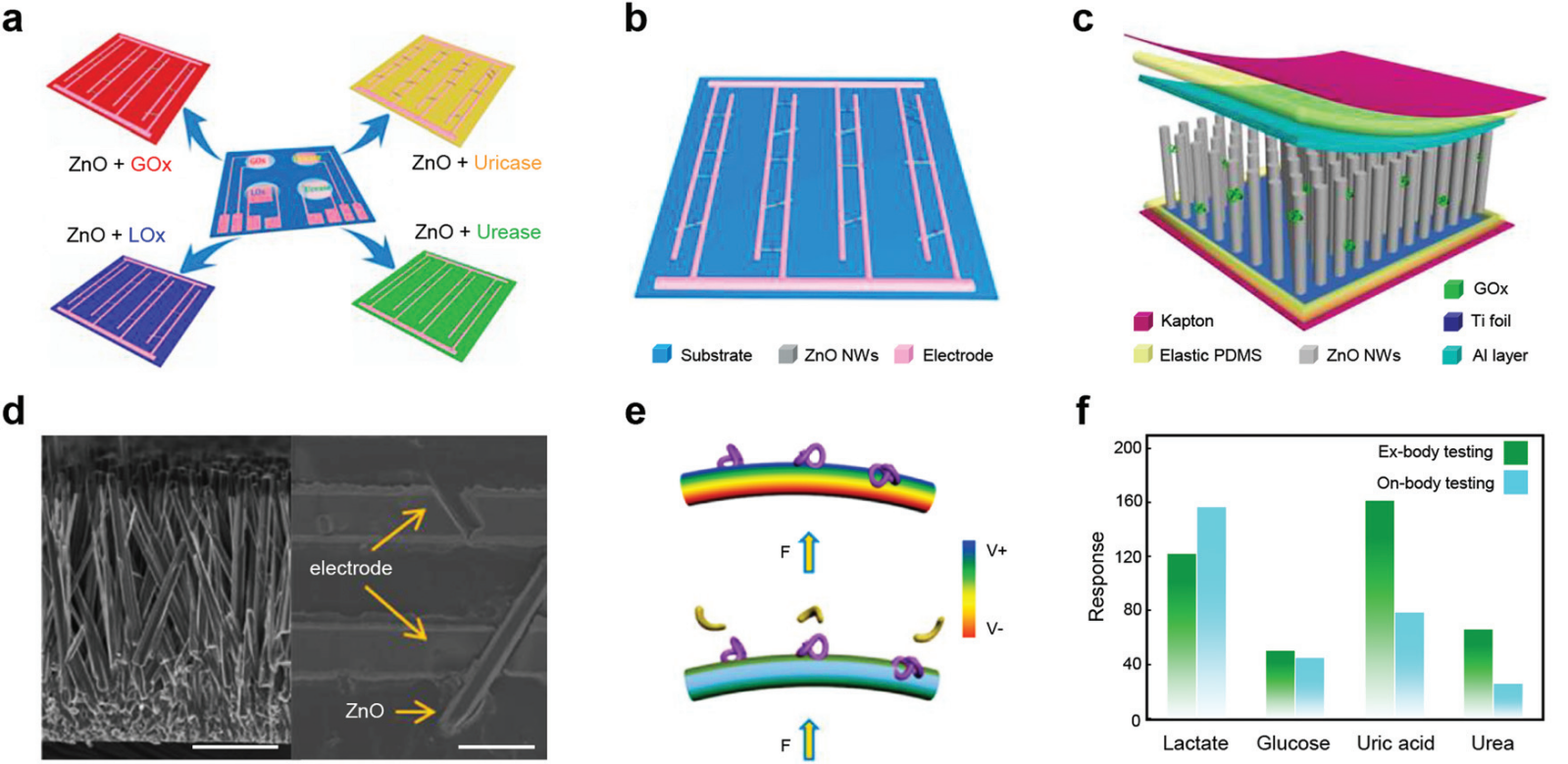
图 14 用于汗液传感的 PENG。 (a) 四个用于汗液分析的自供电可穿戴无创压电生物传感单元。(b) 自供电可穿戴无创电子皮肤的横向设备架构图。(c) 自供电可穿戴无创电子皮肤的垂直设备架构图。(d) ZnO 纳米线阵列和桥接两个 Ti 电极的单个 ZnO 纳米线的 SEM 图像。比例尺,10 μm。(e) 改性 ZnO 纳米线在纯水中通过施加变形产生的压电电位。(f) 对身体和体外测试的反应进行比较。
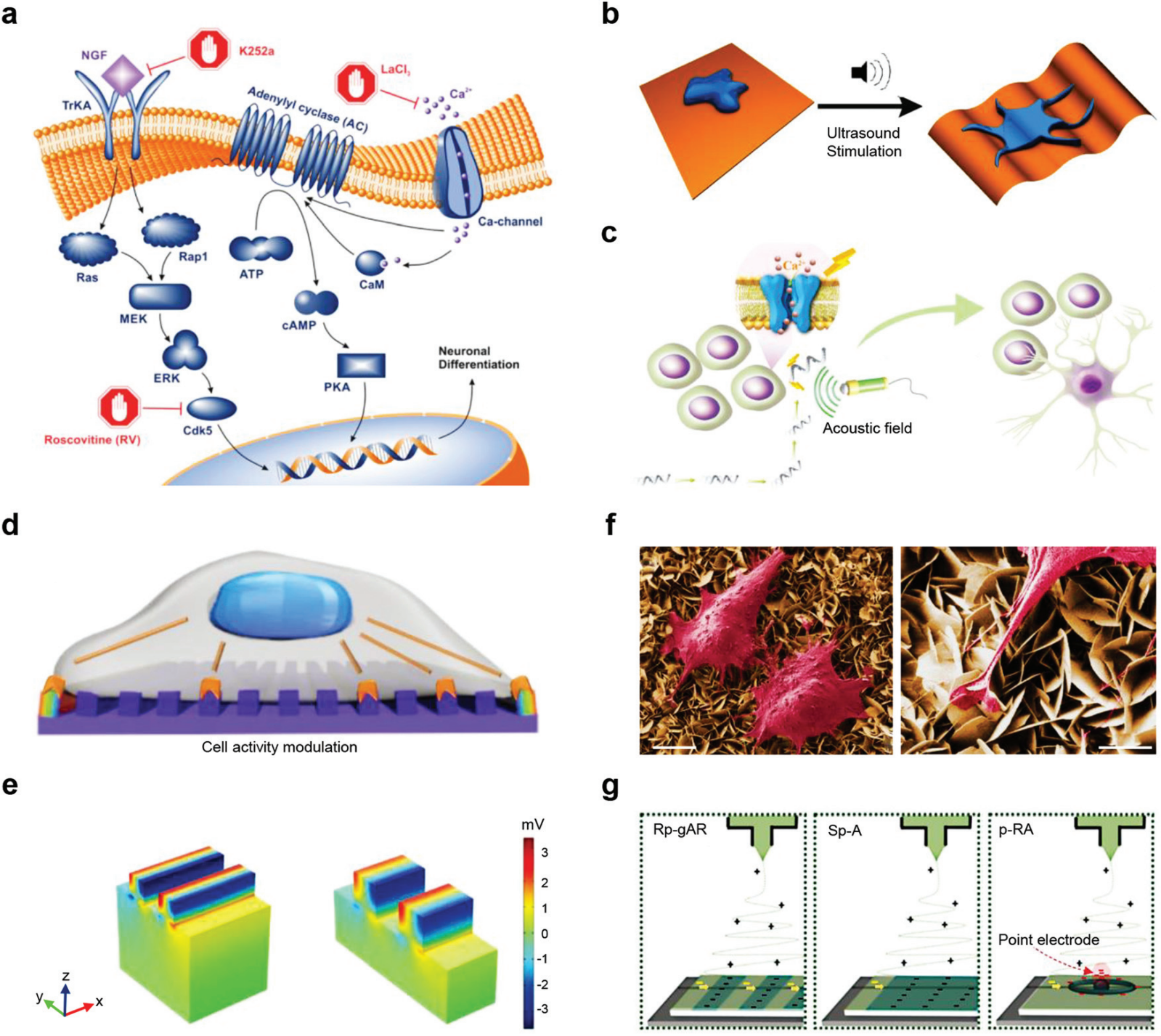
图 15 用于细胞活性调节的 PENG。 (a) 说明影响 PC12 分化的细胞内途径。(b) 压电 β-PVDF 膜的超声刺激示意图,诱导 PC12 细胞的神经元分化。(c) 高度可控微电机诱导目标神经干细胞分化的示意图。(d) 在具有纳米级条纹阵列的 PVDF 表面上生长的活细胞的固有细胞力。(e) 不同条纹阵列的 PVDF 电学模拟结果。(f) 形态和 NG 细胞相互作用的 SEM 图像。比例尺,5 μm(左)和 2 μm(右)。(g) 不同旋转膜的简化生成机制。
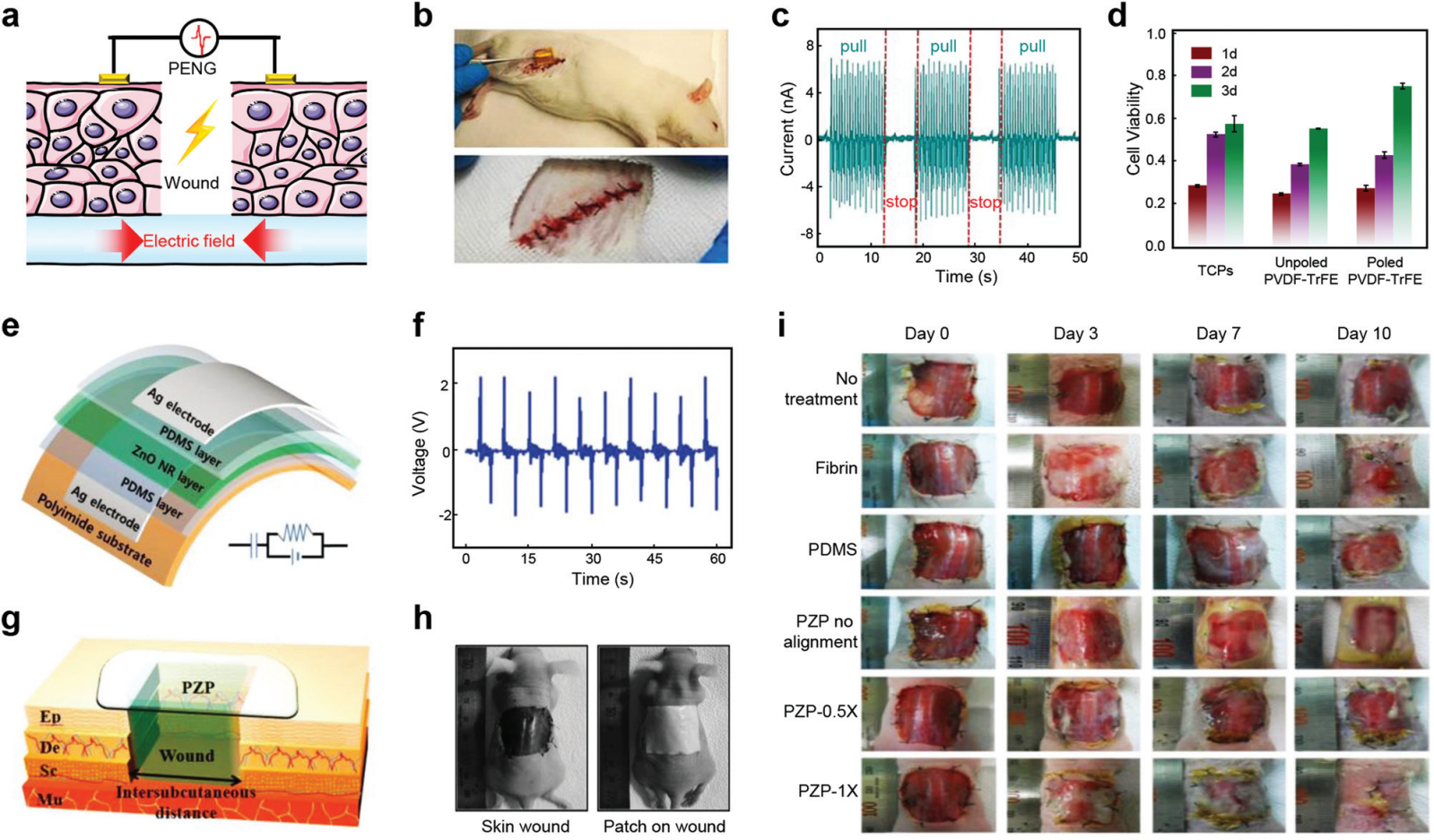
图 16 用于伤口愈合的 PENG。 (a) 在内源电场下引发的伤口愈合机制示意图。(b) 电纺 P(VDF-TrFE) 纳米纤维支架植入大鼠皮下大腿区域(上)和缝合后植入部位(下)的图像。(c) 间歇拉动植入支架的电流输出。(d) L929 成纤维细胞在激发的组织培养聚苯乙烯上增殖的条形图。(e) 用 Ag 电极修饰的 PZP 的示意图,以测量机械弯曲产生的压电电压和电流密度。(f) 通过机械弯曲对 ZnO NR 单层产生的压电电压进行量化。 (g) 皮下距离测量的伤口部位示意图。(h) 小鼠背部皮肤伤口的照片(左),以及通过在 PZP 上覆盖透明薄膜将九层 PZP 放置在伤口上(右)。(i) 治疗后 0、3、7 和 10 天的代表性皮肤伤口照片。
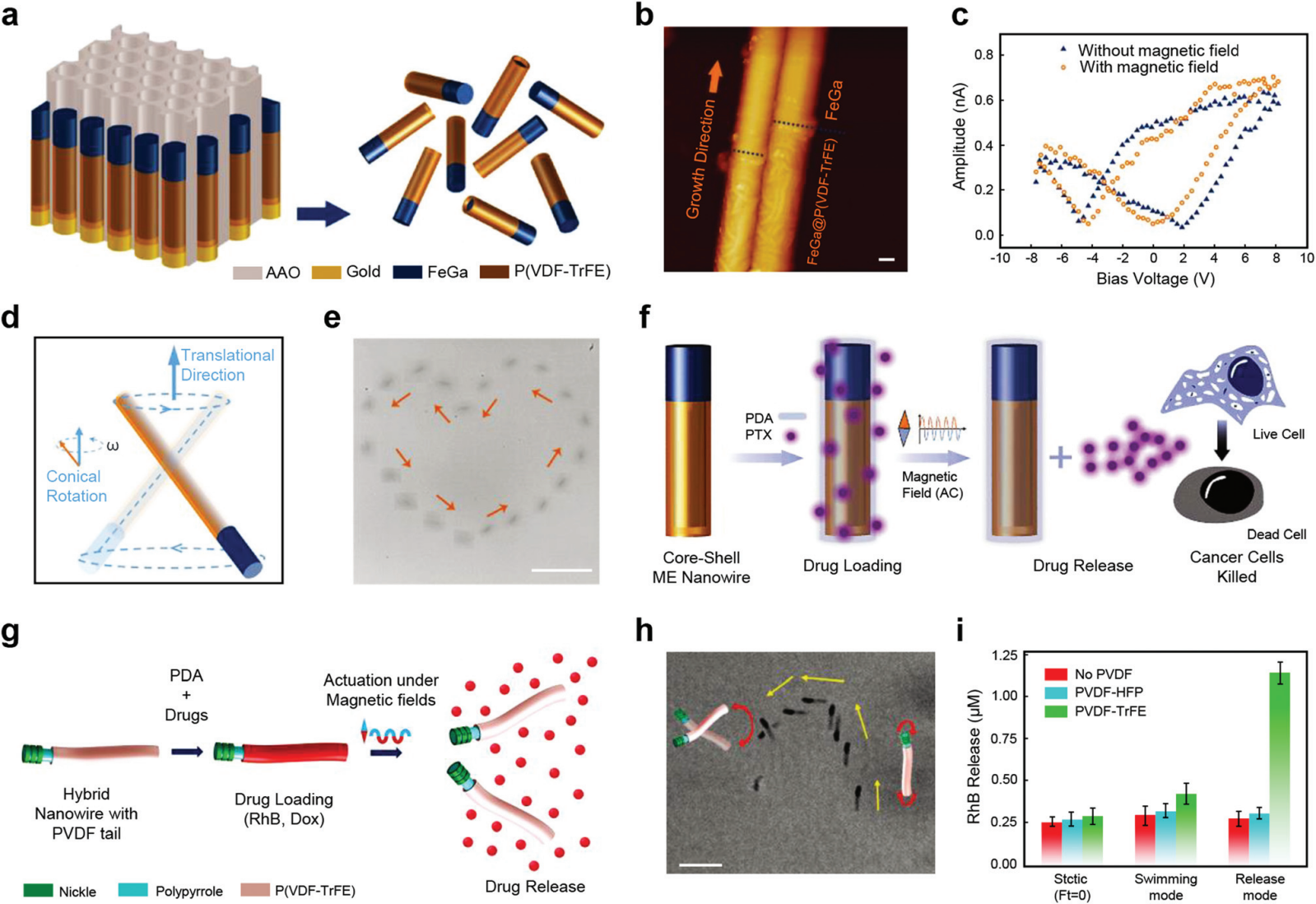
图 17 用于药物输送的 PENG。 (a) FeGa@P(VDF-TrFE)核壳纳米线示意图。(b) 两条纳米线的 AFM 图像,其中 FeGa 由 P(VDF-TrFE) 纳米管生长而成。比例尺,200 nm。(c) 从有和没有磁场暴露的 FeGa@P(VDF-TrFE) 核壳纳米线获得的压电响应幅度环。(d) 核壳纳米线在锥形旋转磁场中的运动示意图。(e) 操纵纳米线以遵循心脏的形状。比例尺,20 μm。(f) 显示按需给药实验的方案。(g) 描述混合纳米线与 PDA 和药物的功能化,然后是磁触发药物释放的方案。(h) 延时图像显示了在改变磁场参数时单个混合纳米细胞从表面行走游泳模式转变为摆动运动。比例尺,15 μm。(i) 显示在不同磁驱动下,无 PVDF、有 P(VDF-HFP) 和有 P(VDF-TrFE) 的 NW 释放 RhB 的图。
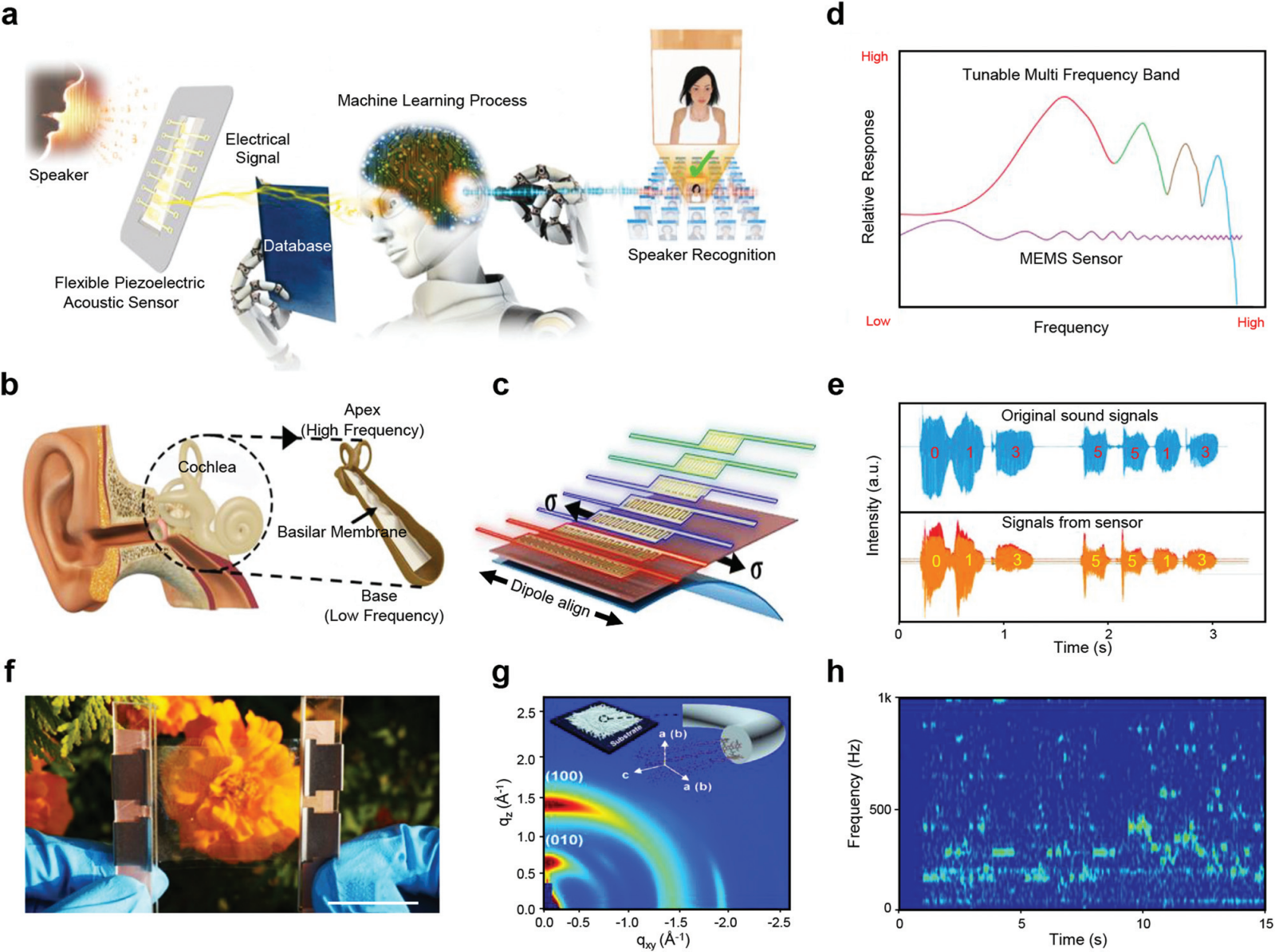
图 18 用于辅助物理治疗的 PENG。 (a) 基于机器学习的说话人识别系统的总体示意图。(b) 受基底膜启发的柔性压电声学传感器的示意图。(c) 受基底膜共振结构启发的微型 PMAS 的仿生多频带控制和移动生物特征认证的示意图。(d) 从多通道中选择的语音频带上产生的最高电信号的示意图。(e) 多通道柔性压电声学传感器记录的标准化女性语音的声音信号和相应的信号。 (f) 夹在两个 Ag NWs 电极之间的透明几丁质扬声器的数码照片。比例尺,3 厘米。(g) 硅衬底上几丁质薄膜的晶体图案。(h) 透明几丁质扬声器的短时傅里叶变换频谱图。
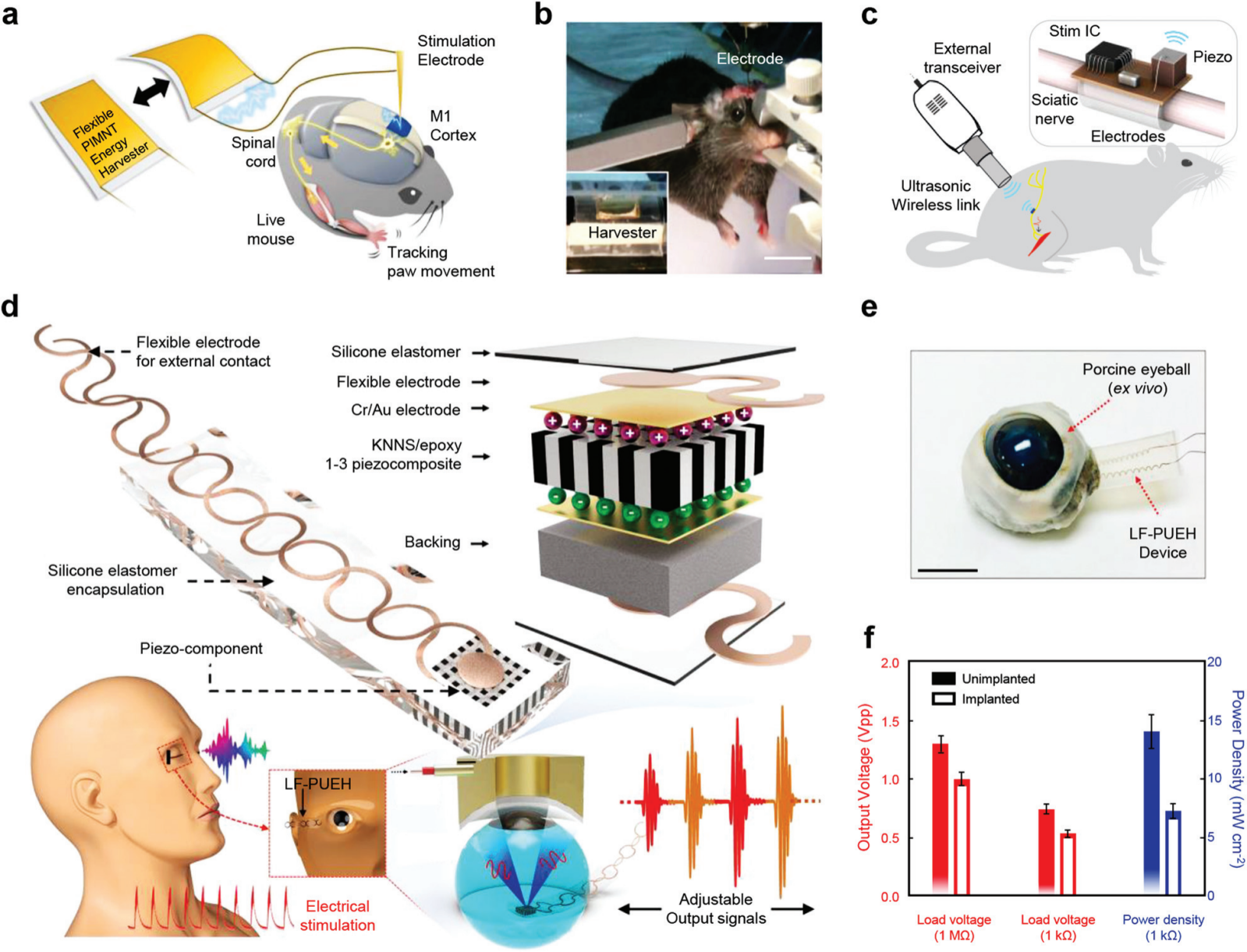
图 19 用于神经刺激的 PENG。 (a) 使用灵活的 PIMNT 收割机对小鼠进行脑刺激的动物实验说明。(b) 连接到双极刺激电极的柔性 PIMNT 刺激器的照片,该电极位于 M1 皮层用于电刺激。比例尺,1 厘米。 (c) 用于刺激大鼠坐骨神经的无电池植入系统示意图。 (d) 用于视网膜电刺激的毫米级柔性超声诱导无线 PENG 的示意图和设计。(e) 植入切除眼球的设备的光学图像,以模拟植入场景。 比例尺,1 厘米。(f) 注入和非注入情况下器件输出电压和功率密度的比较。
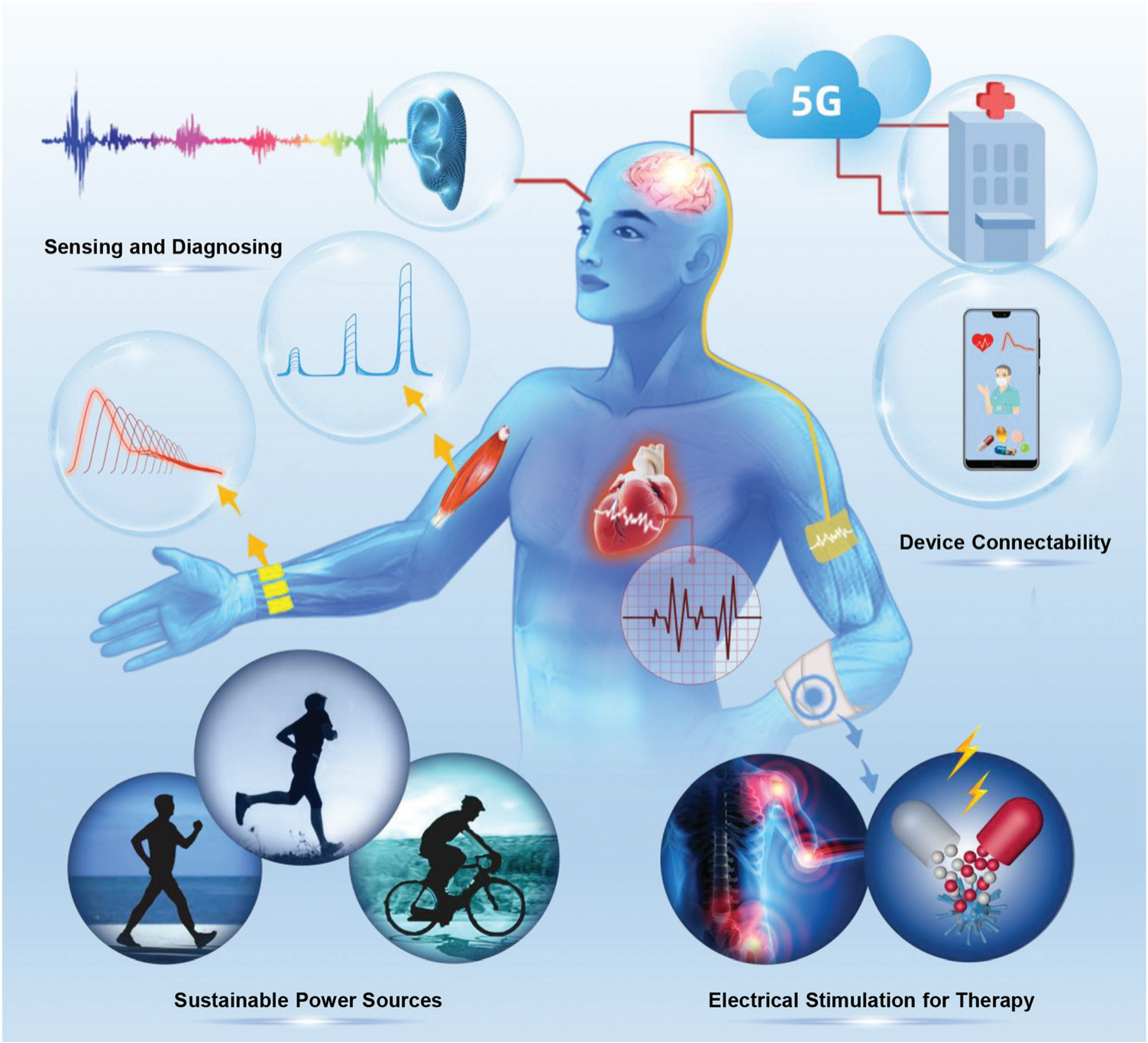
图 20 用于医疗物联网的 PENG。 该智能系统包括高性能传感器,可以检测各种生理信号,并通过 5G 网络将各种生理信号远距离无线传输给医生。数据分析完成后,医生可以通过患者的体内、体侧终端和设备向患者反馈甚至指导治疗,从而实现闭环的个性化医疗保健。
本文链接:
Piezoelectric nanogenerators for personalized healthcare
W. Deng, Y. Zhou, A. Libanori, G. Chen, W. Yang, J. Chen, Chemical Society Reviews, 51, 3380-3435
https://doi.org/10.1039/D1CS00858G