近期,天津大学化工学院仰大勇教授团队在DNA功能材料细胞内可控组装方面取得新进展,团队设计了质子驱动的动态组装体系,实现了细胞内信号驱动的DNA可控组装,构建了人工过氧化物酶体,相关成果发表在Nature Communications。仰大勇教授和姚池副教授为共同通讯作者,主要作者包括硕士生徐毓玮和博士生唐建普。该工作得到国家自然科学基金等资助支持。
活性氧(ROS)是细胞代谢中的重要信号分子,ROS的过量产生或清除不足会导致细胞氧化应激,损伤细胞的结构完整性和细胞器功能,从而影响细胞的增殖、分化和代谢等生物学行为,与多种疾病的发病机制和进程密切相关。过氧化物酶体作为一种多功能细胞器,含有用于清除ROS的氧化还原酶,对于平衡细胞内ROS水平至关重要。鉴于此,在ROS失衡的细胞中构建人工过氧化物酶体,实现对胞内ROS的有效清除,并研究细胞的生物学行为变化,有望探索疾病干预和治疗的新机制、新途径。
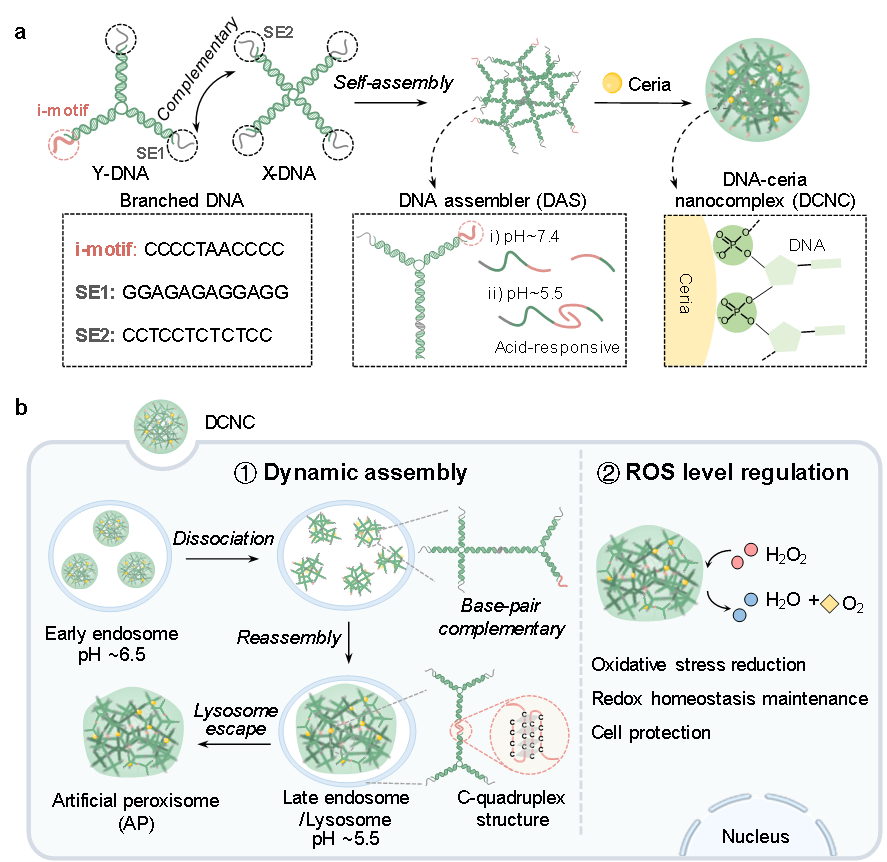
图1. 在活细胞中通过DNA分子动态组装构建人工过氧化物酶体。
仰大勇教授团队构建了一种DNA/氧化铈纳米复合物(DCNC),实现细胞内动态组装,构建人工过氧化物酶体(AP),有效清除胞内ROS,并研究对ROS失衡细胞的生物学行为影响。氧化铈与枝状DNA的磷酸骨架通过配位作用形成纳米尺寸的复合体。进入细胞后,DCNC依次响应早期内涵体和晚期内涵体/溶酶体内的酸性环境,发生自主解组装和再组装,在细胞内部原位形成AP。在细胞中,AP通过氧化铈的功能模拟过氧化物酶体清除高浓度ROS的功能,防止细胞氧化应激。DNA分子可控组装赋予组装材料理性可调的尺寸效应,很好地解决了材料细胞摄取与细胞内滞留的矛盾,纳米尺寸的DCNC有利于细胞摄取,而DCNC在细胞内组装形成AP后尺寸增大,有效延长了胞内滞留时间,增强了ROS清除功效。在此基础上,通过氧化应激模型研究了AP对细胞生物学行为的影响。结果表明,AP通过降低细胞内ROS水平、维持稳定的谷胱甘肽浓度,保护细胞骨架不受损伤,进而维持了细胞的迁移能力。对线粒体膜电位、Ca2+浓度以及胞内ATP水平的测定,证明AP能够使细胞在受到ROS攻击后仍维持正常的代谢以及生理活动。此外,细胞活性等相关实验验证,AP能够使细胞在高浓度H2O2环境中仍维持高活性,有效地抑制了细胞凋亡。该工作证明了在细胞内原位构建AP的可行性,并且验证了清除ROS的能力,这是未来进一步应用的必要基础。这项工作启发研究者利用胞内复杂的生物微环境,以及细胞和亚细胞水平上生物刺激的差异性,在特定位置进行可控组装,调控细胞或细胞器功能,为疾病干预和治疗探索新的途径。
原文链接:https://www.nature.com/articles/s41467-022-35472-2
仰大勇课题组以生物大分子DNA为研究主线,聚焦DNA生物功能材料化学组装与智能制造,并应用于生命分析和疾病治疗。
课题组主页:http://yanglab-dna.com/
图文转载自【中国聚合物网】:http://www.polymer.cn/