水凝胶由于其良好的结构柔性、较高的通透性和出色的生物相容性,是构建软电子和生物医学设备的理想材料。近年来导电水凝胶的不断发展,为可植入生物电极、软体致动器、组织工程平台、太阳能水处理和其他先进技术创造了更多的可能性。然而,尽管进行了大量的研究工作,在水凝胶中同时实现高导电性和机械强韧性仍然具有挑战性,大大限制了它们的实际应用。传统导电水凝胶的制备中在聚合物基质中加入导电填料来赋予水凝胶导电性。然而,这些方法获得的导电水凝胶性能并不理想。一方面,为构建导电通路,提高导电性,往往需要加入大量的导电填料;另一方面,大量导电填充物的加入,通常伴随着水凝胶机械性能的下降,限制了其的应用场景。纯导电聚合物水凝胶的开发获得了高的电导率,但导电聚合物固有的脆性使这些水凝胶表现出较低的机械强度。
为解决上述问题,香港大学机械工程系徐立之教授团队利用纳米纤维三维超连接网络的模板效应来辅助导电聚合物的组装,导致其具有超低的电渗流阈值(~ 1wt %)。复合纳米纤维网络提供了良好的导电通路和结构框架,使合成的导电纳米纤维水凝胶(CNHs)同时具备高机械强度(~9.4 MPa)和电子导电性(~80 Scm-1)。此外,通过掩膜法或激光切割等方法,可以对CNHs进行图案化,使其作为用于细胞、组织和器官电生理学应用的高性能生物电子工具成为可能。相关研究成果以标题为“Hybrid Assembly of Polymeric Nanofiber Network for Robust and Electronically Conductive Hydrogels”发表在《Nature Communications》上,香港大学机械工程系博士生何慧敏和李昊为共同一作,徐立之教授为本文通讯作者。
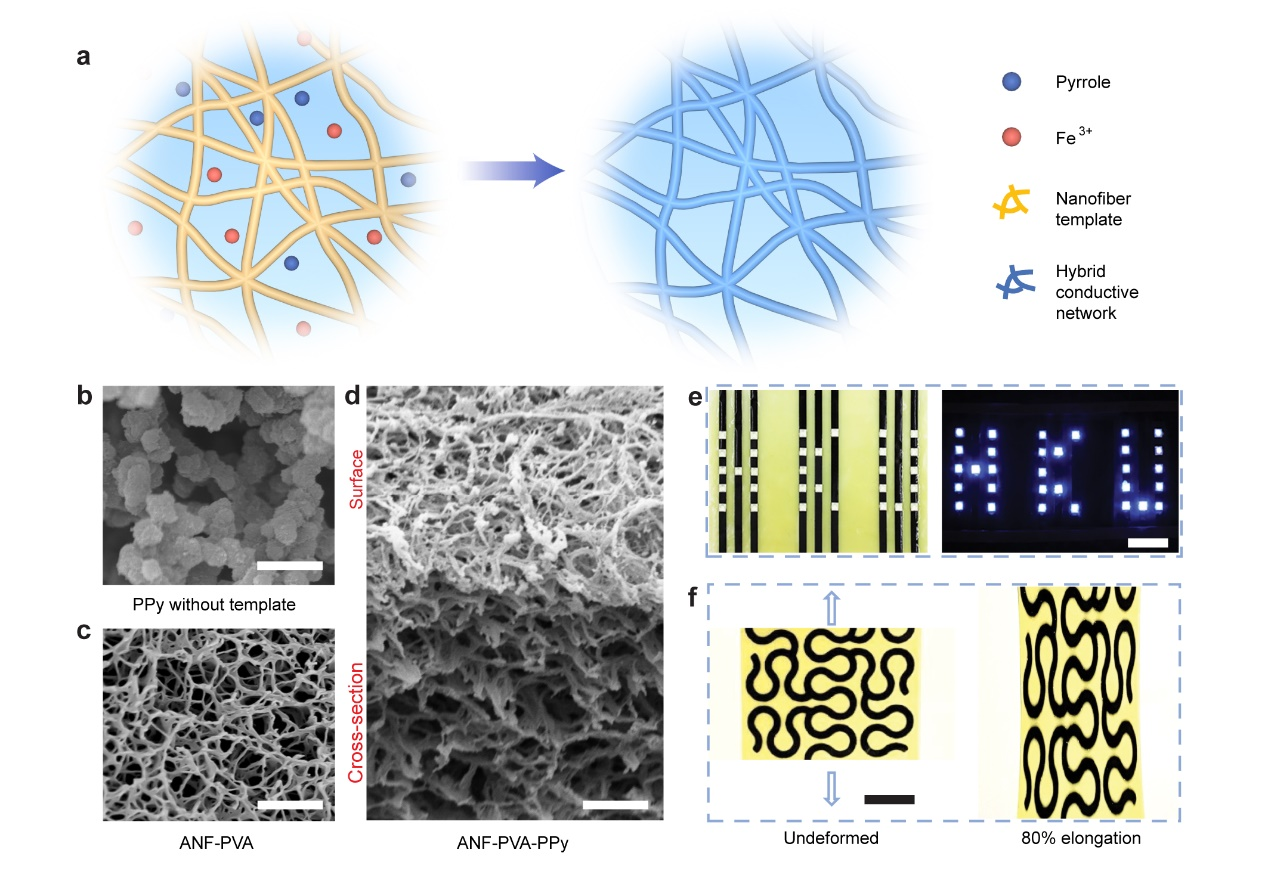
图1,CNHs的合成及结构表征
利用芳纶纳米纤维(ANF)自组装三维网络,通过水交换法,生成具有高度连接的3D纤维网络的水凝胶,作为导电聚合物组装的模板,通过加入PVA进一步提高机械性能。将吡咯单体渗透到水介质中的纳米多孔水凝胶中(图1a),然后与添加的FeCl3氧化剂进行聚合。这种简单的过程导致混合纳米纤维网络具有非常有效的电渗透合成导电聚合物(即聚吡咯,PPy)。扫描电子显微镜(SEM)显示,在没有纳米纤维模板的水介质中,PPy倾向于形成随机分布的颗粒(图1b)。在ANF-PVA的存在下(图1c),合成的PPy符合具有相同网络拓扑结构的纳米纤维框架(图1d)。通过对CNHs图案化可用作电极点亮LED(图1e)以及具有高机械强度的蛇形图案(图1f)薄膜。
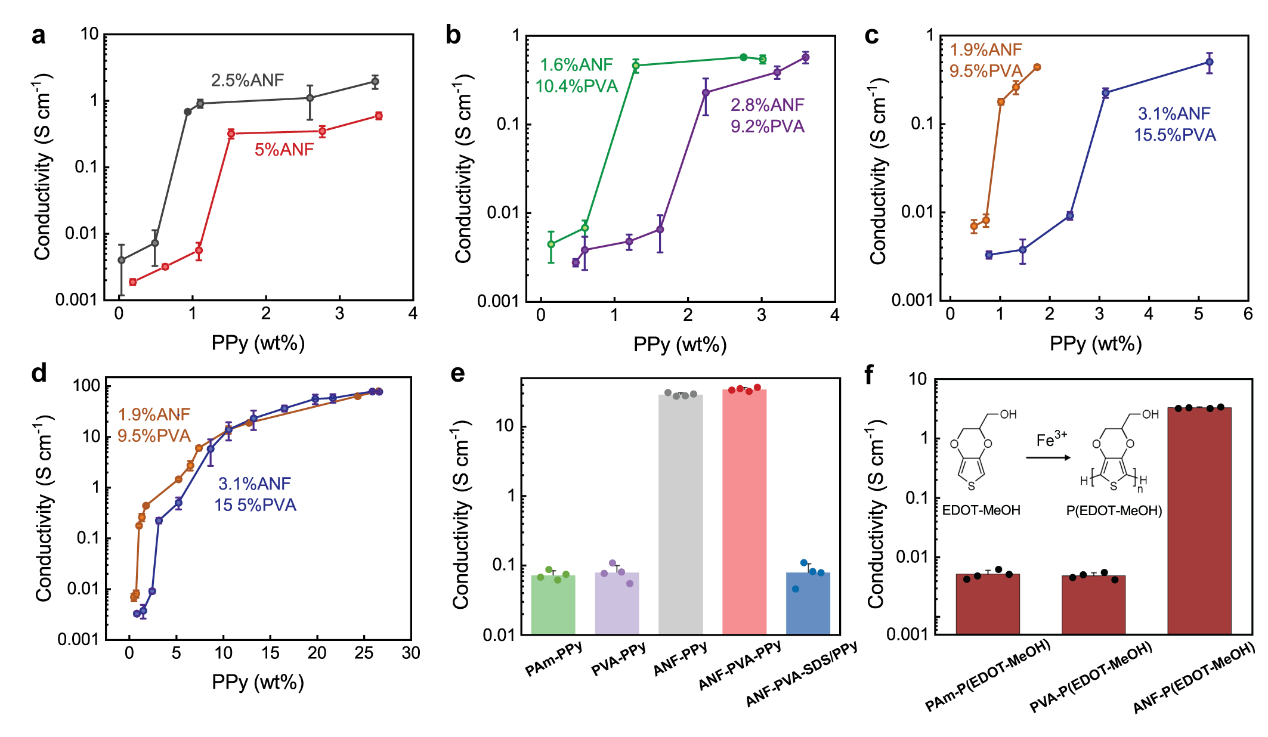
图2,CNHs的导电性
在高度连接的纳米纤维模板的引导下,PPy以非常低的体积分数组装成渗透传导通路,在5 wt% ANFs的CNHs中PPy的渗透阈值略高于1 wt%。在2.5 wt% ANFs的CNHs中,PPy的渗透阈值下降到1wt %以下(图2a)。这一现象可以理解为纤维网络越稀疏,形成连续导电通路所需的PPy越少,对应形成传导通路的阈值越低。这种现象在加入PVA后依然存在(图b,c和d)。对一系列其他无ANF的水凝胶进行验证后,证明了ANF的模板作用(图e),且这种模板作用也适用与其他常用的导电聚合物如PEDOT图(图f)。
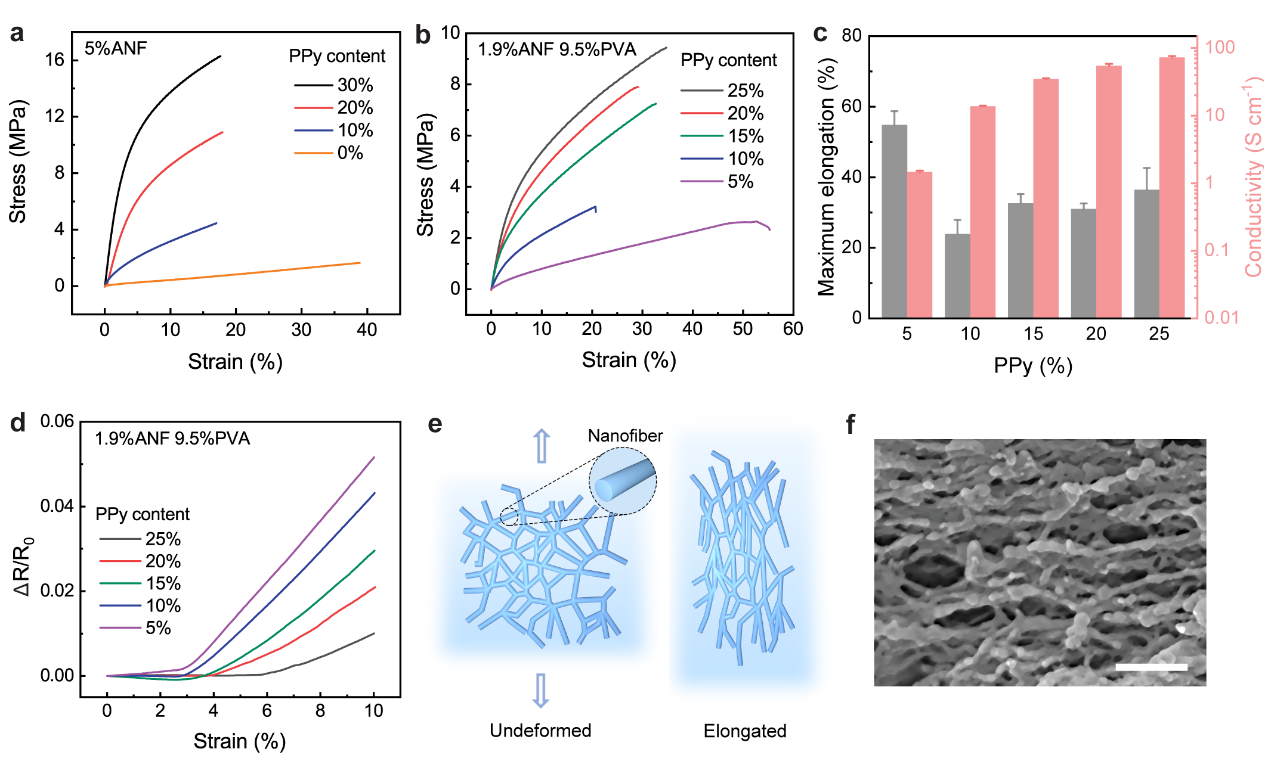
图3,CNHs的机械性能
ANF-PPy水凝胶表现出的高强度,根据PPy的固体含量从1.6 MPa到17.6 MPa不等(图3a)。为了提高CNHs的形变性能,在水凝胶基体中加入PVA,使ANF-PVA-PPy水凝胶的拉伸性能明显高于ANF-PPy(图3b)。在不同PPy含量的负载下,机械拉伸以及导电性可调控(图3c)。此外,ANF-PVA-PPy样品在施加伸长范围内应力下电阻变化可以忽略不计(~3%-6%)(图3d)。这一特征可以归因于混合纳米纤维网络的重新定向,它可以适应宏观拉伸而不改变传导通路的拓扑结构(图3e)。从拉伸样品的SEM表征来看,纳米纤维网络根据机械载荷表现出明显的取向(图3f),这表明微观结构重构有助于CNHs在应变下保持电阻不变。
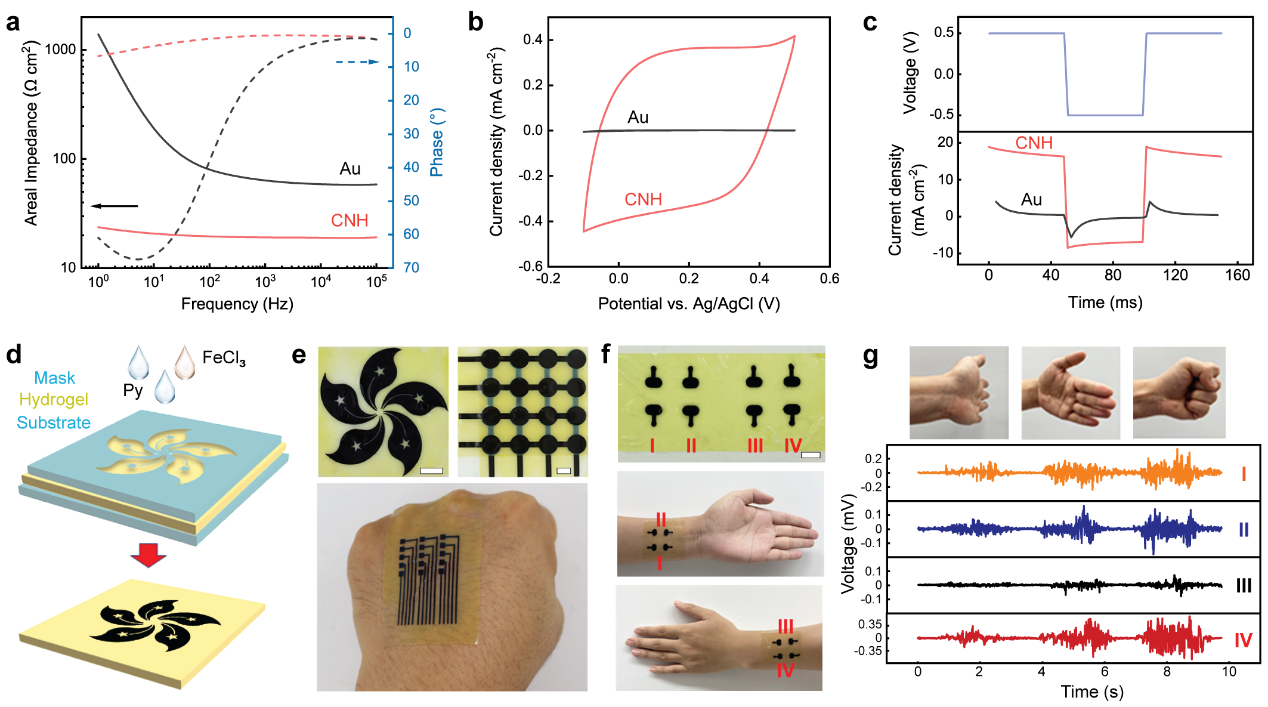
图4,CNHs在软生物电子学中的应用
在PBS中,CNHs在生理相关频率范围内的单位面积电化学阻抗比薄膜金电极低67.2%至98.3%(图4a)。CNH的低阻抗源于纳米结构提供了高的界面电容,有利于精确表征低信号幅值的各种生物电活动。与金电极相比,CNHs在储存(图4b)和注入(图4c)电荷方面也表现出较高的能力,这对于向生物组织传递电刺激是有利的。对CNH进行图案化(图4d,e)并用于测量肌电图(EMG)(图4f和g),获得了高质量的电生理信号。通过贴合在前臂上的四个独立CNH电极的EMG记录来描述不同的手部运动,证明其可作为一种人机交互的手段。
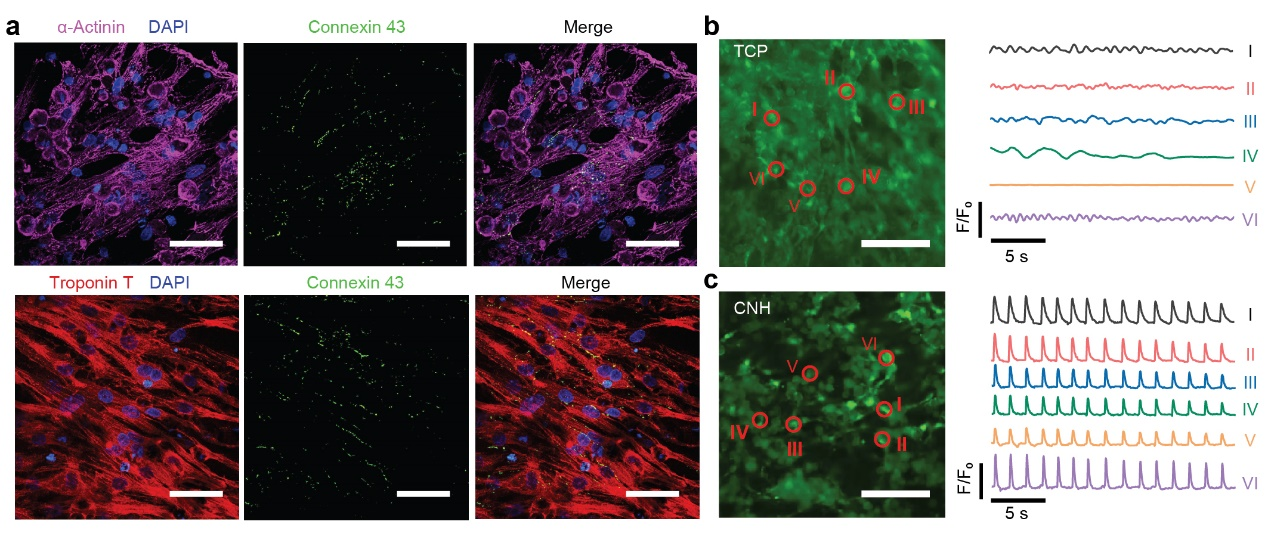
图5,CNHs用于调控心肌细胞
新生大鼠心肌细胞被种植在CNH样品上,在CNHs上生长的心肌细胞快速成熟,表现为良好的细胞排列和心脏特异性蛋白的显著表达(图5a),其中α-肌动蛋白和肌钙蛋白T负责心肌收缩,连接蛋白43参与电和机械耦合的间隙连接。此外,钙瞬态成像显示,CNHs培养的心肌细胞与TCP培养的心肌细胞有明显的收缩行为。培养在刚性且不导电的TCPs上的心肌细胞表现出弱而随机的兴奋,与细胞之间没有协调(图5b)。相反,附着在CNH上的细胞表现出自发和同步的兴奋,由柔软和导电CNH基质促进机电传导(图5c)。
论文链接:https://www.nature.com/articles/s41467-023-36438-8
图文转载自【中国聚合物网】:http://www.polymer.cn/