铁离子递送是诱发和增敏肿瘤细胞铁死亡的重要策略。然而铁离子的肿瘤选择性递送和可控释放具有极大挑战性,现有方法包括构建含铁无机粒子(例如Fe3O4)、有机配体与铁离子络合物、以及铁代谢调控。近年来含铁机械力敏感基团(Mechanophore)和机械力敏感聚合物的发展为超声应答递送铁离子及铁死亡增敏提供了契机, 但此类铁基聚合物的释铁性能依赖于聚合物的超高分子量,限制了其在铁死亡抗肿瘤领域的应用。
近日,天津大学药学院赵燕军教授、王征教授团队设计了侧链共价偶联机械力敏感基团(二茂铁)的两亲性聚乙二醇-聚赖氨酸双嵌段共聚物,并利用肿瘤特殊的微环境(细胞内高浓度H2O2),克服了超声应答铁离子释放对聚合物分子量的依赖性,从而规避了超高分子量二茂铁聚合物合成复杂、水相环境溶解分散性能差、释铁效率低等缺点。具体机理为超声促进相关中间产物及降解副产物中过氧键的断裂,进而促进二茂铁鎓离子的生成和降解,最终促进铁离子释放 (图1)。
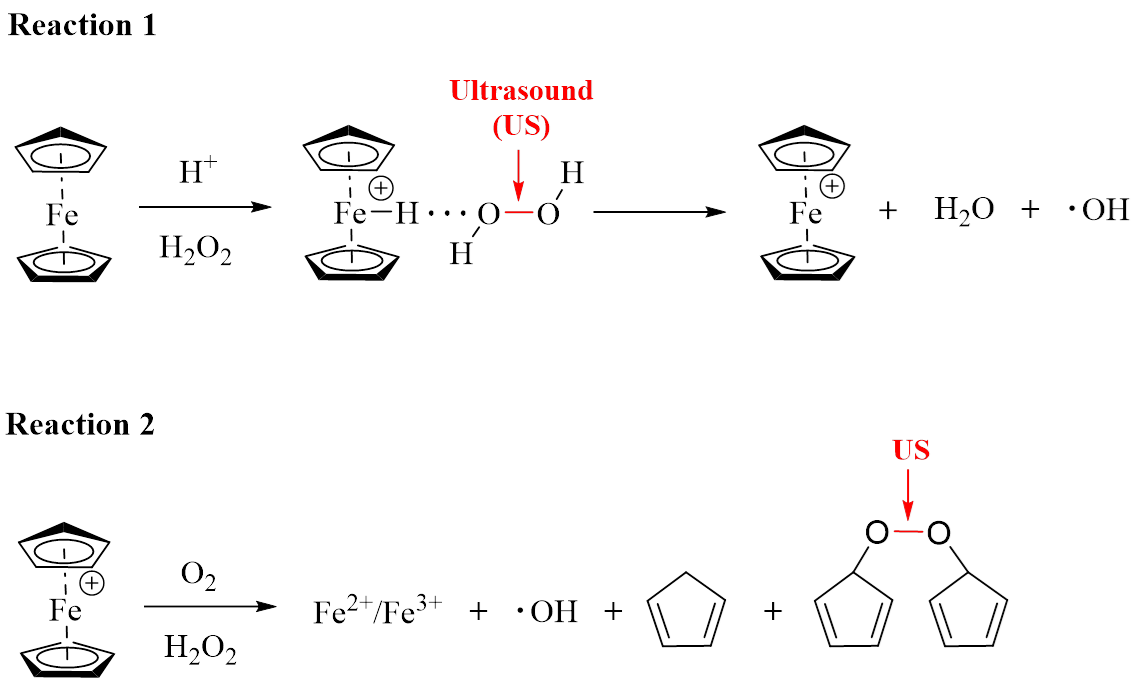
图1. 过氧化氢辅助的超声促二茂铁降解及铁离子释放机理示意图。
在此基础上,该团队选择原卟啉IX为模型药物,利用低分子量二茂铁两亲性共聚物为药物载体,在模型细胞和整体动物水平验证了超声波增强的铁死亡和凋亡抗肿瘤协同疗法(图2)。原卟啉IX为声敏剂,在超声作用下生成单线态氧,二茂铁在肿瘤细胞内具有双重作用,释放铁离子和羟基自由基。铁离子在高浓度H2O2条件下诱发脂质过氧化和细胞铁死亡。单线态氧和羟基自由基分别是声动力学疗法和化学动力学疗法的主要“活性分子”,二者通常诱发肿瘤细胞凋亡,此外还可衰减细胞内谷胱甘肽和硫氧还蛋白来进一步增敏铁死亡。超声波是一种独特的外源性刺激,具有组织穿透能力强、非侵入性等优点。由于两亲性高分子可构建胶束和囊泡载体,因此二茂铁聚合物载体为各类疏水和亲水药物的机械力应答递送提供了新的平台技术。该工作以“Mechano-Responsive Leapfrog Micelles Enable Interactive Apoptotic and Ferroptotic Cancer Therapy”为题发表在《Advanced Functional Materials》杂志,天津大学药学院博士生李瑶同学为论文第一作者。
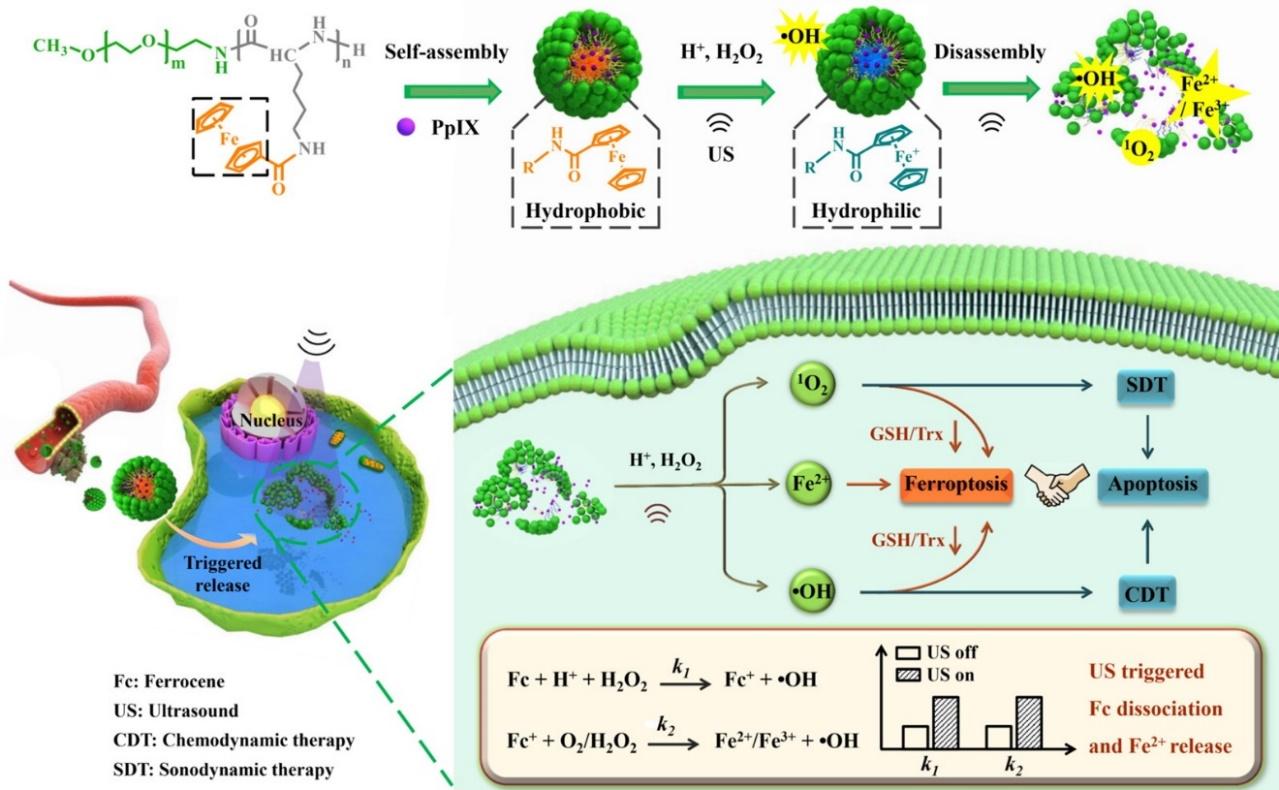
图2. 机械力敏感二茂铁聚合物纳米药物递送系统示意图。
该工作是团队近期关于细胞铁死亡调控药物载体研究的最新进展之一。天津大学药学院赵燕军团队聚焦基于新型细胞死亡机理的药物递送基础与转化研究,近年来在肿瘤微环境应答型药物载体领域取得系列进展(Adv. Funct. Mater., 2021, 31, 2009157; ACS Nano, 2020, 4, 14715; Nano Lett., 2020, 20, 6235; Nano Lett., 2019, 19, 7866; Biomaterials, 2019, 223, 119486)。更多信息见课题组主页:http://faculty.tju.edu.cn/zhaoyj
论文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202112000